
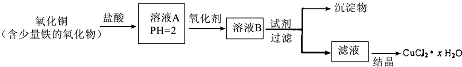
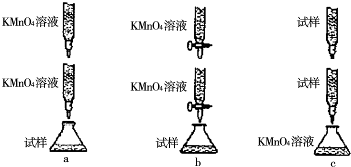


科目:高中化学 来源: 题型:
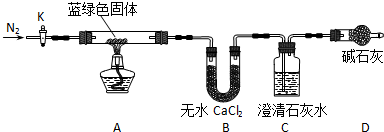
 (1)某研究性学习小组的同学将一置于空气中的铝片投入浓CuCl2溶液中,铝片表面出现一层暗红色物质,此后铝片上开始产生大量气泡,溶液温度迅速上升,暗红色物质表面有黑色固体生成.
(1)某研究性学习小组的同学将一置于空气中的铝片投入浓CuCl2溶液中,铝片表面出现一层暗红色物质,此后铝片上开始产生大量气泡,溶液温度迅速上升,暗红色物质表面有黑色固体生成.
| 氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
| Ksp | 1.0×10-15 | 1.0×10-29 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
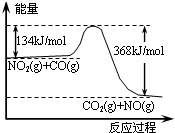
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述不正确的是
反应mA(固)+nB(气)?eC(气)+fD(气),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述不正确的是| A、达到平衡后,加入催化剂,C%不变 |
| B、该反应为放热反应 |
| C、化学方程式中m+n>e+f |
| D、达到平衡后,增加A的质量有利于平衡向右移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:
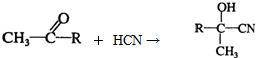
| ||
| H+ |
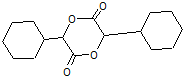

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 |
| B、可以用氢氧化铜悬浊液检验甘油和酒精 |
| C、通过化学变化可以实现16O与18O间的相互转化 |
| D、由金属元素和非金属元素形成的化学键一定是离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com