
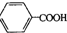
 )在一定条件下反应生成酯的种类有( )
)在一定条件下反应生成酯的种类有( )| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 分子式为C4H10O的醇的种类取决于-C4H9的种类,-C4H9异构体有4种:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,然后确定与苯甲酸( )在一定条件下反应生成酯的种类.
)在一定条件下反应生成酯的种类.
解答 解: 的结构固定,则分子式为C4H10O的醇与苯甲酸(
的结构固定,则分子式为C4H10O的醇与苯甲酸( )在一定条件下反应生成酯的种类取决于分子式为C4H10O的醇的数目,
)在一定条件下反应生成酯的种类取决于分子式为C4H10O的醇的数目,
分子式为C4H10O的醇的种类取决于-C4H9的种类,-C4H9异构体有4种:-CH2CH2CH2CH3,-CH(CH3)CH2CH3,-CH2CH(CH3)CH3,-C(CH3)3,则C4H10O的醇有四种,
所以二者形成酯的种类为4种,
故选C.
点评 本题考查了同分异构体的书写,题目难度不大,明确同分异构体的概念及书写原则为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 将乙醛加入新制Cu(OH)2悬浊液中并加热至沸腾,出现红色沉淀 | |
| B. | 将乙醇滴入酸性K2Cr2O7溶液中,溶液由橙色变为绿色 | |
| C. | 将SO2通入滴有酚酞的NaOH溶液中,溶液红色褪去 | |
| D. | 新制氯水敞口处久置,颜色褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色透明的酸性溶液:MnO4-、K+、Cl-、SO42- | |
| B. | 0.1 mol/LNaHCO3溶液:Na+、Ba2+、NO3-、OH- | |
| C. | 使酚酞变红的溶液:K+、Na+、NO3-、Cl- | |
| D. | 滴加KSCN显红色的溶液:NH4+、K+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ①④ | C. | ③④⑥ | D. | ①③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用排饱和食盐水法收集Cl2 Cl2+H2O?H++Cl-+HClO | |
| B. | 纯碱溶液加热使溶液碱性增强CO32-+2H2O?H2CO3+2OH- | |
| C. | 向Mg(OH)2悬浊液中加入FeCl3溶液,悬浊液颜色改变3Mg(OH)2(s)+2Fe3+=2Fe(OH)3(s)+3Mg2+ | |
| D. | 配制FeCl3溶液时,为防止溶液浑浊,常将FeCl3固体溶解于浓盐酸,再加水稀释Fe3++3H2O?Fe(OH)3+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com