【答案】
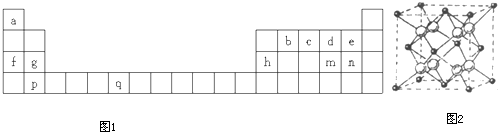
分析:由元素在周期表中位置可知,a为H、b为C、c为N,d为O、e为F、f为Na、g为Mg、h为Al、m为S、n为Cl、p为Ca、q为Cr;
(1)元素q处于周期表中第四周期第ⅥB族,为25号Cr元素,根据核外电子排布规律书写外围电子排布式;
(2)A.同周期自左而右,元素的电负性增大;
B.同周期自左而右,第一电离能增大,但g为Mg元素,3s能级为全满稳定状态,能量降低,第一电离能高于同周期相邻元素;
C.CO
2与SO
2都属于酸性氧化物,化学性质具有一定类似性,CO
2是直线对称结构,为非极性分子,对于ABn型分子,A原子的最外层电子全部成键,该分子是非极性分子,据此判断SO
2分子极性;
D.离子键强越强,晶格能越高,MgF
2中Mg
2+的电荷比Na
+的多、半径都比NaF中Na
+的半径小,故MgF
2中离子键更强;
E.C
2H
2分子的立体构型是直线形,该分子中含有1个C≡C三键,2个C-H,单键为σ键,三键中有1个σ键、2个π键;
(3)对于ABn型分子,中心原子A原子的最外层电子全部成键,空间结构为平面正三角形,中心原子A原子的最外层电子未全部成键,空间结构为V形;
NH
3分子中,N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,N原子采取sp
3杂化;
(4)由CaF
2晶胞利用均摊计算原子数目,判断晶胞中哪种球代表F
-离子,根据晶胞观察F
-离子的配位数.
解答:解:根据元素在周期表中位置可知,a为H、b为C、c为N,d为O、e为F、f为Na、g为Mg、h为Al、m为S、n为Cl、p为Ca、q为Cr,
(1)元素q处于周期表中第四周期第ⅥB族,为25号Cr元素,常用周期表中d区,外围电子排布式为3d
54s
1;
故答案为:d,3d
54s
1;
(2)A.同周期自左而右,元素的电负性增大,故b、c、d元素的电负性逐渐增大,故A正确;
B.同周期自左而右,第一电离能增大,但g为Mg元素,3s能级为全满稳定状态,能量降低,第一电离能高于同周期相邻元素,故大于电离能Mg>Al>Na,故B错误;
C.CO
2与SO
2都属于酸性氧化物,化学性质具有一定类似性,CO
2是直线对称结构,是非极性分子,SO
2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,SO
2为极性分子,故C错误;
D.离子键强越强,晶格能越高,MgF
2中Mg
2+的电荷比Na
+的多、半径都比NaF中Na
+的半径小,故MgF
2中离子键更强,晶格能更大,故D正确;
E.C
2H
2分子的立体构型是直线形,该分子中含有1个C≡C三键,2个C-H,单键为σ键,三键中有1个σ键、2个π键,分子中σ键和π键的个数比为3:2,故E正确;
故选ADE;
(3)SO
2分子中S元素化合价为+4,S原子最外层6个电子未全部成键,故SO
2分子空间结构为V形;NH
3分子中,N原子成3个N-H键,含有1对孤对电子,杂化轨道数目为4,N原子采取sp
3杂化;
故答案为:V形,sp
3;
(4)由CaF
2晶胞结构可知,黑色球数目为6×

+8×

=4,白色球为8,故白色球是F
-离子,由晶胞可知,每个F
-离子周围有4个Ca
2+离子,故F
-离子的配位数为4;
故答案为:4.
点评:考查元素周期表的结构、核外电子排布规律、元素周期律、分子结构与性质、晶胞等,综合性较大,难度中等,是对知识的综合运用,(4)中注意判断离子.


 +8×
+8× =4,白色球为8,故白色球是F-离子,由晶胞可知,每个F-离子周围有4个Ca2+离子,故F-离子的配位数为4;
=4,白色球为8,故白色球是F-离子,由晶胞可知,每个F-离子周围有4个Ca2+离子,故F-离子的配位数为4;