
| 气体 | CO | H2 | N2 | O2 |
| 体积(L) | 25 | 60 | 15 | 2.5 |
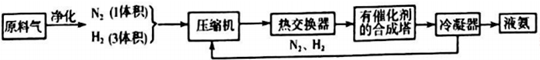
分析 (1)根据空气中含有大量的氮气分析;根据反应的方程式结合表中数据列方程式计算;
(2)根据合成氨在催化剂高温高压条件下进行,则在合成氨的原科气中混有的杂质必须除去的原因是防止催化剂中毒;热交换器的作用是充分利用能源,降低成本;物质的循环使用可以节约原料,提高利用率;
(3)采用400℃-500℃的温度,根据合成氨为放热反应,对氨的合成不利,但可考虑催化剂的活性增大反应速率;
(4)根据反应前后原子守恒书写化学方程式;
(5)电解池的阴极发生得电子的还原反应,总反应式减去阳极电极反应式,即为阴极电极反应式.
解答 解:(1)因为空气中含有大量的氮气,并且成本很低,所以合成氨所需的氮气来源于空气;
设反应消耗的H2O为xmol,O2为ymol,则根据CH4(g)+H2O(g)=CO(g)+3H2(g)和2CH4(g)+O2(g)=2CO(g)+4H2(g),
得$\left\{\begin{array}{l}{x+2y=25}\\{3x+4y=60}\end{array}\right.$
x=10,y=7.5
V(O2):V(N2)=$\frac{2.5+7.5}{15}$=2:3,
故答案为:空气;2:3;
(2)因为合成氨的原科气中混有的杂质可能使催化剂中毒,所以在合成氨的原科气中混有的杂质必须除去;热交换器的作用是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气,充分利用能源,降低成本;未反应的N2和H2,可以循环使用,这样循环可以提高原料气的利用率,
故答案为:防止催化剂中毒;热交换器是利用合成氨和氨冷凝放出的热量来加热原料气体或预热反应混合气;将N2,H2循环利用;
(3)采用400℃-500℃的温度,根据合成氨为放热反应,对氨的合成不利,但该温度范围内反应速率较快,主要考虑催化剂的活性较大,
故答案为:该温度下催化剂的活性较大;
(4)①氮气与二氧化碳在加热加压条件下化合生成氨基甲酸铵(H2NCOONH4),则发生的化学方程式为:2NH3+CO2$\stackrel{加热加压}{→}$H2NCOONH4,
故答案为:2NH3+CO2$\stackrel{加热加压}{→}$H2NCOONH4;
②氨基甲酸铵受热分解为尿素与水,则发生的化学方程式为:H2NCOONH4$\stackrel{△}{→}$CO(NH2)2+H2O,故答案为:H2NCOONH4$\stackrel{△}{→}$CO(NH2)2+H2O;
(5)总反应式为N2+3H2=2NH3,阳极的电极反应为3H2-6e-═6H+,总反应式减去阳极电极反应式即为阴极电极反应式,所以阴极电极反应式为:N2+6H++6e-═2NH3,
故答案为:N2+6H++6e-═2NH3.
点评 本题考查学生合成氨的原理以及应用等知识,侧重于学生分析能力和问题解决能力的考查,注重于化学对生活、生产的指导,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 液氨中含有H2O,NH3•H2O,NH3,NH4+,NH2-等微粒 | |
| B. | 液氨中c(NH4+)•c(NH2-)是一个随温度升高而减小的常数 | |
| C. | 液氨的电离达到平衡时c(NH3)=c(NH4+)=c(NH2-) | |
| D. | 任何温度下,只要不加入其他物质,液氨中c(NH4+)和c(NH2-)一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
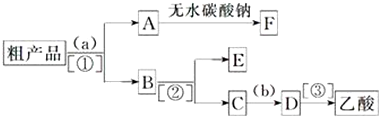
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
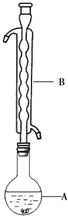
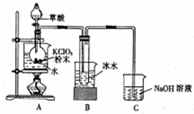 二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:
二氧化氯是一种高效消毒剂,在60℃时用氯酸钾与草酸反应可生成二氧化氯,实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
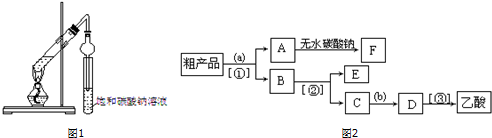
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.
Na2S2O3俗称大苏打(海波)是重要的化工原料.用Na2SO3和硫粉在水溶液中加热反应,可以制得Na2S2O3.已知10℃和70℃时,Na2S2O3在水中的溶解度分别为60.0g和212g.常温下,从溶液中析出的晶体是Na2S2O3•5H2O.| 滴定次数 | 滴定前读数(mL) | 滴定滴定后读数(mL) |
| 第一次 | 0.00 | 30.82 |
| 第二次 | 0.00 | 30.80 |
| 第三次 | 0.00 | 30.78 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
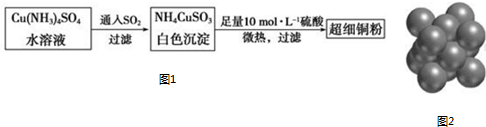
 ; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).
; NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为N>O>S(填元素符号).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ | |
| B. | 稀硫酸与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 盐酸与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com