
下列各组物质中,所含氯原子(包含氯离子)个数最多的是( )
|
| A. | 448mL(标准状况)Cl2 | B. | 0.5mol HCl |
|
| C. | 13.35g AlCl3 | D. | 1L 0.5mol/L MgCl2溶液 |
考点:
物质的量的相关计算.
分析:
根据n=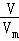 计算氯气物质的量,根据n=
计算氯气物质的量,根据n=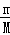 计算氯化铝物质的量,根据n=cV计算氯化镁物质的量,结合化学式中含有氯原子数目计算氯原子物质的量,据此解答.
计算氯化铝物质的量,根据n=cV计算氯化镁物质的量,结合化学式中含有氯原子数目计算氯原子物质的量,据此解答.
解答:
解:A.标况下448mL氯气物质的量为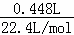 =0.02mol,含有原子为0.02mol×2=0.04mol;
=0.02mol,含有原子为0.02mol×2=0.04mol;
B.0.5molHCl含有Cl为0.5mol;
C.13.35g氯化铝的物质的量为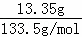 =0.1mol,含有氯原子为0.1mol×3=0.2mol;
=0.1mol,含有氯原子为0.1mol×3=0.2mol;
D.氯化镁物质的量为1L×0.5mol/L=0.5mol,含有氯离子为0.5mol×2=1mol,
故氯化镁溶液中含有氯原子最多,
故选D.
点评:
本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心的有关计算.


科目:高中化学 来源: 题型:
Cu(OH)2在水中存在着如下溶解平衡:Cu(OH)2 (s)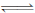 Cu2+ (aq)+ 2OH- (aq),在常温下Ksp[Cu(OH)2]=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol • L﹣1,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于
Cu2+ (aq)+ 2OH- (aq),在常温下Ksp[Cu(OH)2]=2×10-20。某CuSO4溶液中,c(Cu2+)=0.02 mol • L﹣1,在常温下要生成Cu(OH)2沉淀,需要向CuSO4溶液中加入碱溶液来调节溶液的pH,使溶液的pH大于
| A.2 | B.3 | C.4 | D.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
五种短周期元素的某些性质如表所示(其中Z、M、W为同周期元素).下列说法不正确的是( )
| 元素代号 | Y | X | W | M | Z |
| 原子半径(×10﹣12m) | 64 | 73 | 78 | 96 | 113 |
| 主要化合价 | ﹣1 | +5、﹣3 | +7、﹣1 | +4、﹣4 | +3 |
|
| A. | 由M与W形成的化合物是含有极性键的极性分子 |
|
| B. | X与M之间形成的化合物,其晶体是原子晶体 |
|
| C. | 由M元素形成的晶体,是太阳能光伏发电的主要材料,工业上制取M单质,可通过置换反应原理来生产 |
|
| D. | Y与Z元素形成的[ZY6]3﹣,离子中存在配位键,该离子构型呈正八面体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、Q、M为常见的短周期元素,其原子序数依次增大.有关信息如表:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
(1)X的气态氢化物的大量生产曾经解决了地球上因粮食不足而导致的饥饿和死亡问题,请写出该气态氢化物的电子式 .
(2)已知37Rb和53I都位于第五周期,分别与Z和M同一主族.下列有关说法正确的是 (填序号).
A.原子半径:Rb>I B.RbM中含有共价键
C.气态氢化物热稳定性:M>I
D.Rb、Q、M的最高价氧化物对应的水化物可以两两发生反应
(3)若XM3最初水解产物是XH3和HMO,则X、M元素的电负性大小顺序是:X M((填>、<、或=);若已知磷与M元素电负性关系是:P<M,则PM3水解的化学反应方程式是 .
(4)已知QM3的熔点为190℃(2.02×105Pa),但它在180℃即开始升华,则QM3是 (填“离子化合物”或“共价化合物”),如何通过实验判 .在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g/L,则QM3的结构式为 .
(5)X、Y组成的一种无色气体遇空气变为红棕色.将标准状况下40L该无色气体与15L氧气通入一定浓度的NaOH溶液中,恰好被完全吸收,同时生成两种盐.请写出该反应的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素位于第三周期第ⅥA族.下列叙述不正确的是( )
|
| A. | 该元素是非金属元素 |
|
| B. | 该元素原子的核电荷数为16 |
|
| C. | 该元素原子核外有3个电子层 |
|
| D. | 该元素原子容易失去最外层电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列措施中不能起到节能降耗和保护环境目的是( )
|
| A. | 加大太阳能、水能、风能、地热能等能源开发力度,减少化石燃料的使用 |
|
| B. | 研制乙醇汽油技术,降低机动车辆尾气中有害气体排放 |
|
| C. | 生产、生活中,努力实现资源的循环利用 |
|
| D. | 利用高新技术,提高石油、煤、天然气产量,以满足工业生产快速发展的需求 |
查看答案和解析>>
科目:高中化学 来源: 题型:
2012年12月,酒鬼酒塑化剂事件引起大家关注,塑化剂中主要含有的是邻苯二甲酸酯( 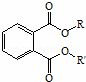 R和R′为不同的烷基)类物质,关于邻苯二甲酸酯的下列叙述正确的是( )
R和R′为不同的烷基)类物质,关于邻苯二甲酸酯的下列叙述正确的是( )
|
| A. | 若R为甲基,R′为乙基,其分子式为C11H13O4 |
|
| B. | 1mol邻苯二甲酸酯可以和2mol NaOH反应 |
|
| C. | 1mol邻苯二甲酸酯可以和5mol H2加成 |
|
| D. | 苯环上的一氯代物有2种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com