
【题目】硫酸是一种重要的化工产品,2SO2+O2![]() 2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是( )
2SO3是生产过程中的重要反应。下列对于该反应的说法中正确的是( )
A.只要选择适宜的条件,SO2和O2就能全部转化为SO3
B.该反应达到平衡后,反应就完全停止了,即正逆反应速率均为零
C.如果反应前充入由18O原子组成的O2,反应达到平衡状态时, 18O在所有物质中都存在
D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。

(1)将上述反应设计成的原电池如图甲所示,请回答下列问题:
①图中X溶液是 ;②Cu电极上发生的电极反应式为 ;
③原电池工作时,盐桥中的 离子(填“K+”或“Cl—”)不断进入X溶液中。
(2)将上述反应设计成的电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是 极;②图丙中的②线是 离子的变化。
③当电子转移为2mol时,向乙烧杯中加入 L 5mol·L-1NaOH溶液才能使所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
Na2FeO4+3H2↑,则电解时阳极的电极反应式是 。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为 。
③Na2FeO4能消毒、净水的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 某校学生用化学知识解决生活中的问题,下列家庭小实验中不合理的是( )
A.用食醋除去暖水瓶中的薄层水垢
B.用米汤检验含碘盐中的碘酸钾(KIO3)
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用灼烧并闻气味的方法区别纯棉织物和纯毛织物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有部分短周期元素的性质或原子结构如下表:

(1)四种元素原子半径由大到小的顺序是(写元素符号)_________________________。
(2)元素Y与氢元素形成的一种离子YH4+,写出该微粒的电子式________(用元素符号表示)。
(3)T元素的简单阴离子的结构示意图是______________________,
(4)证明该粒子的还原性比Z-强的离子方程式是____________________.
(5)元素Z的单质与氢氧化钠溶液反应的化学方程式为_______________________ 。
(6)将9g单质X在足量氧气中燃烧,所得气体通入1L 1mol·L-1NaOH溶液中,完全吸收后,将溶液在减压低温条件下蒸干,得到不含结晶水的固体质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室模拟工业生产碳酸钠:一定温度下,往一定量饱和NaCl溶液中通入氨气达到饱和后,再不断通入CO2,一段时间后,出现沉淀,过滤得到NaHCO3晶体。
(1)该过程的化学方程式: 。
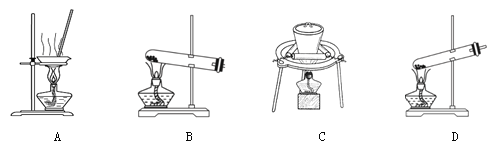
(2)加热NaHCO3得到纯碱制品,实验室可进行此操作的装置是 。
(3)得到的纯碱制品含有少量NaHCO3和NaCl,设计实验验证样品中各种组分。
试剂和仪器限选用:试管、胶头滴管、过滤装置、Ba(NO3)2溶液、NaOH溶液、AgNO3溶液、澄清石灰水、稀硫酸、稀盐酸、稀硝酸。
步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解。往试管中加入 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论: 。 |
步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入 , 振荡,观察; | 现象: ; 结论:样品中含有NaHCO3。 |
步骤三:将步骤二的浊液过滤,取滤液于试管C中, 振荡,观察。 | 现象: ; 结论: 。 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷及其化合物在生产、生活中有重要的用途。回答下列问题:
(1)已知磷酸(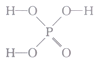 )分子中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2) 却不能与D2O发生氢交换。则H3PO2是(填“一元”“二元”或“三元”)酸,其分子的结构式为________(填字母)。
)分子中的三个氢原子都可以与重水分子(D2O)中的D原子发生氢交换。又知次磷酸(H3PO2)也可与D2O进行氢交换,但次磷酸钠(NaH2PO2) 却不能与D2O发生氢交换。则H3PO2是(填“一元”“二元”或“三元”)酸,其分子的结构式为________(填字母)。

(2)H3PO2具有较强的还原性,可以通过电解的方法制备。“四室电渗析法”工作原理如图所示(阳离子交换膜和阴离子交换膜分别只允许阳离子、阴离子通过)。

①阳极的电极反应式为_________。
②II 膜为___________(填“阴离子交换膜”或“阳离子交换膜”)。
③早期采用“三室电渗析法”制备H3PO2,将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的交换膜,从而合并阳极室与产品室,其缺点是产品中混有______杂质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.聚乙烯是无毒高分子化合物,可用作食品包装
B.在日常生活中,电化学腐蚀是造成钢铁腐蚀的主要原因
C.推广使用新能源,可以减少二氧化碳等温室气体的排放
D.人造纤维、合成纤维和光导纤维都是有机高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】腈纶织物广泛地用作衣物、床上用品等。腈纶是由CH2=CH-CN聚合而成的,CH2=CH-CN可以由下列反应制得:□CH3-CH=CH2+□NH3+□O2→□CH2=CH-CN+□H2O
丙烯可以由石脑油裂解制得:C10H22→2C3H6+X
(1)配平方程式:□CH3-CH=CH2+□NH3+□O2→□CH2=CH-CN+□H2O
(2)写出上述反应式中X的同分异构体的结构简式 ;
(3)生物质含有葡萄糖、淀粉和纤维素等糖类,也称碳水化合物,绿色植物将二氧化碳和水变成碳水化合物,写出由二氧化碳和水变成葡萄糖的化学方程式 ;
(4)葡萄糖在碱性、加热条件下,能与 (试剂名称)反应析出光亮的金属;在加热条件下,也可与新制的氢氧化铜反应,写出该反应现象 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只给出下列甲和乙中对应的物理量,不能求出物质的量的是( )
A | B | C | D | |
甲 | 物质中的粒子数 | 标准状况下的气体摩尔体积 | 固体的体积 | 溶液中溶质的物质的量浓度 |
乙 | 阿伏加德罗常数 | 标准状况下的气体的体积 | 固体的密度 | 溶液体积 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com