
| A. | 14 | B. | 15 | C. | 16 | D. | 17 |
分析 25℃时,某一元强碱溶液的pH为a,则溶液中c(OH-)=10a-14mol/L,某一元酸HA溶液的pH为b,c(H+)=10-bmol/L,电离度为1.0%,则酸为弱酸,其浓度c(HA)=$\frac{1{0}^{-b}mol/L}{1.0%}$=102-bmol/L,然后根据将1体积的此强碱溶液与10体积的HA溶液混合,恰好完全反应来分析.
解答 解:25℃时,某一元强碱溶液的pH为a,则溶液中c(OH-)=10a-14mol/L,某一元酸HA溶液的pH为b,c(H+)=10-bmol/L,电离度为1.0%,则酸为弱酸,其浓度c(HA)=$\frac{1{0}^{-b}mol/L}{1.0%}$=102-bmol/L,而将1体积的此强碱溶液与10体积的HA溶液混合,恰好完全反应,故有:10a-14mol/L×VL=102-bmol/L×10VL
解得a+b=15.
故选B.
点评 本题考查了强碱和弱酸混合后的有关计算,应注意的是电离度=$\frac{物质电离的物质的量}{物质的总物质的量}$×100%,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 简单离子的半径:B>C>D>A | |
| B. | 氢化物的稳定性:C>D | |
| C. | B和其他3种元素均能形成离子化合物 | |
| D. | B与D形成的化合物溶于水所得溶液显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的氧化剂为N2,还原产物为CO | |
| B. | 反应中每生成0.1mol Si3N4转移电子的物质的量为1.2mol | |
| C. | 增大压强平衡向正反应方向移动 | |
| D. | 反应平衡常数表示为K=$\frac{c(CO)}{c({N}_{2})}$,升高温度K值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
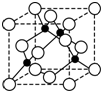 A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题:
A、B、C、D、E、F是周期表前四周期的元素,且原子序数依次递增,已知A是宇宙中含量最多的元素,B元素能形成的化合物种类最多,E原子的半径是所在周期最大的,E和D形成的某化合物是呼吸面具中气的来源,F基态原子有6个来成对电子.请回答下列问题: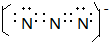 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 是非金属元素 | B. | 单质是分子晶体 | ||
| C. | R(OH)4-结合H+的能力小于Al(OH)4- | D. | R2H6中R为-3价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
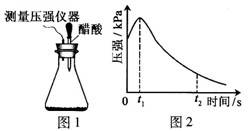
| A. | t2时容器中压强明显小于起始压强原因是铁发生了吸氧腐蚀 | |
| B. | 0~t2时压强变大的原因可能是铁发生了析氢腐蚀 | |
| C. | 0~t1时压强变大的原因可能是腐蚀过程为放热反应,锥形瓶内气体温度升高 | |
| D. | 钢铁在酸性条件下一定发生析氢腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应 | 大气固氮N2(g)+O2(g)?2NO(g) | |
| 温度/℃ | 27 | 2260 |
| K | 3.84×10-31 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④②③⑤ | B. | ④①②③⑤ | C. | ⑤③②①④ | D. | ④①③⑤② |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com