
 ,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目
,写出其与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目 .
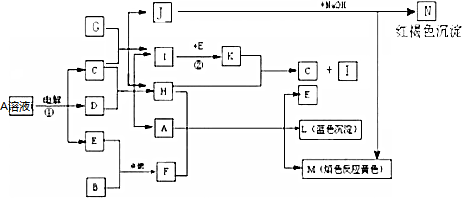
.分析 已知B、D、G是常见的金属单质,I与E反应生成K,K为红棕色气体,则K为NO2,E为常见非金属单质,E为O2,I为NO,H常温下为无色液体,K与H反应生成C,则H为水,C为HNO3,G与C反应生成I和H及J,J与氢氧化钠反应生成N为红褐色沉淀,则N为Fe(OH)3,J为Fe(NO3)3,所以G为Fe,H、A、F反应生成E、L、M,L为蓝色沉淀,则L为Cu(OH)2,M的焰色反应为黄色,所以B为Na,F为Na2O2,M为NaNO3,A为Cu(NO3)2,电解硝酸铜溶液生成铜、氧气、硝酸,符合题中各物质的转化关系,据此答题;
解答 解:已知B、D、G是常见的金属单质,I与E反应生成K,K为红棕色气体,则K为NO2,E为常见非金属单质,E为O2,I为NO,H常温下为无色液体,K与H反应生成C,则H为水,C为HNO3,G与C反应生成I和H及J,J与氢氧化钠反应生成N为红褐色沉淀,则N为Fe(OH)3,J为Fe(NO3)3,所以G为Fe,H、A、F反应生成E、L、M,L为蓝色沉淀,则L为Cu(OH)2,M的焰色反应为黄色,所以B为Na,F为Na2O2,M为NaNO3,A为Cu(NO3)2,电解硝酸铜溶液生成铜、氧气、硝酸,符合题中各物质的转化关系,
(1)根据上面的分析,F为Na2O2,F的电子式为 ,Na2O2与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目为
,Na2O2与CO2反应的化学方程式并用双线桥标出电子转移的方向和数目为 ,
,
故答案为: ;
; ;
;
(2)反应①为电解硝酸铜溶液生成铜、氧气、硝酸,反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4 H+,
故答案为:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4 H+;
(3)C为HNO3,G为Fe,C与足量G反应的化学方程式为3Fe+8HNO3(稀)═3Fe(NO3)2+4H2O+2NO↑,根据方程式可知,还原剂与氧化剂的物质的量之比3:2,检验反应中生成亚铁离子,可以用高锰酸钾溶液,能使高锰酸钾溶液褪色,则有亚铁离子,反应的离子方程式为2MnO4-+10Fe2++16H+=2Mn2++10Fe3++8H2O,
故答案为:3Fe+8HNO3(稀)═3Fe(NO3)2+4H2O+2NO↑;3:2;2MnO4-+10Fe2++16H+=2Mn2++10Fe3++8H2O;
(4)A为Cu(NO3)2,Al能与A发生置换反应,生成物溶质为硝酸铝,铝离子与碳酸根离子能发生双水解,反应的离子方程式为2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑,
故答案为:2Al3++3CO32-+3H2O═2Al(OH)3↓+3CO2↑;
(5)I为NO,I可由氨气催化氧化得到,其化学反应方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(6)漂白粉露置于空气中失效的化学反应方程式为Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑,
故答案为:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO,2HClO$\frac{\underline{\;光\;}}{\;}$2HCl+O2↑.
点评 本题考查无机物推断,以E为常见非金属单质,H常温下为无色液体,K为红棕色气体,及各物质的转化关系 为解题的突破口,本题涉及的反应较多、元素种类较多,难度较大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量 | B. | 密度 | C. | 电子总数 | D. | 分子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于氧化性Fe3+>H+,故反应先不产生气体后产生气体 | |
| B. | 反应后产生13.44LH2(标准状况) | |
| C. | 反应后溶液中Fe2+和Fe3+物质的量之和为0.9mol | |
| D. | 反应后溶液中Fe3+物质的量为0.8mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知:①CH2CH2Br+NaCN$\stackrel{醇}{→}$CH3CH2CN+NaBr;
已知:①CH2CH2Br+NaCN$\stackrel{醇}{→}$CH3CH2CN+NaBr;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③⑤⑥ | C. | ②③⑥ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的柔软金属(除铯外) | |
| B. | 密度都比较小 | |
| C. | 碱金属单质都与水剧烈反应 | |
| D. | 单质的熔、沸点随原子序数的增加而升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 能导电的物质 | 电解质 | 酸 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
工业上曾经通过反应“3Fe+4NaOH Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com