
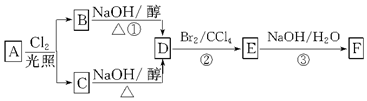
分析 88gCO2为2mol,45gH2O为2.5mol,标况下11.2L烃A为0.5mol,所以烃A中含碳原子为4,H原子数为10,则A的学式为C4H10,C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照发生一氯取代时有两种产物,且在NaOH醇溶液作用下发生消去反应的产物只有一种,则A只能是异丁烷,取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,故D为CH2=C(CH3)2,D与溴发生加成反应生成E为CH2BrCBr(CH3)2,E生成碱性水解得F为CH2OHCOH(CH3)2,据此答题.
解答 解:88gCO2为2mol,45gH2O为2.5mol,标况下11.2L烃A为0.5mol,所以烃A中含碳原子为4,H原子数为10,则A的学式为C4H10,C4H10存在正丁烷和异丁烷两种,但从框图上看,A与Cl2光照发生一氯取代时有两种产物,且在NaOH醇溶液作用下发生消去反应的产物只有一种,则A只能是异丁烷,取代后的产物为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,故D为CH2=C(CH3)2,D与溴发生加成反应生成E为CH2BrCBr(CH3)2,E生成碱性水解得F为CH2OHCOH(CH3)2,
(1)根据上面的分析可知,A的分子式是C4H10,
故答案为:C4H10;
(2)B和C均为一氯化烃,它们的名称(系统命名)分别为2-甲基-1-氯丙烷和2-甲基-2-氯丙烷,
故答案为:2-甲基-1-氯丙烷;2-甲基-2-氯丙烷;
(3)根据上面的分析可知,D的结构简式为 CH2=C(CH3)2,D中碳原子相当于乙烯中的碳和氢,所以是都处于同一平面上的,
故答案为:CH2=C(CH3)2;是;
(4)E为CH2BrCBr(CH3)2,E的同分异构体的结构简式是CH2BrCH(CH3)CH2Br、CHBr2CH(CH3)2、CH2BrCHBrCH2CH32、CH2BrCH2CHBrCH3、CH2BrCH2CH2CH2Br、CHBr2CH2CH2CH3、CH3CBr2CH2CH3、CH3CHBrCHBrCH3,
故答案为:CH2BrCH(CH3)CH2Br、CHBr2CH(CH3)2、CH2BrCHBrCH2CH32、CH2BrCH2CHBrCH3、CH2BrCH2CH2CH2Br、CHBr2CH2CH2CH3、CH3CBr2CH2CH3、CH3CHBrCHBrCH3;
(5)根据上面的分析可知,①、③的反应类型依次是消去反应、取代反应,
故答案为:消去反应;取代反应;
(6)反应③的化学方程式为CH2BrCBr(CH3)2+2NaOH$→_{△}^{水}$CH2OHCOH(CH3)2+2NaBr,
故答案为:CH2BrCBr(CH3)2+2NaOH$→_{△}^{水}$CH2OHCOH(CH3)2+2NaBr;
点评 本题有机物的推断与合成,涉及分子式的判断、反应类型、化学方程式的书写以及同分异构体的判断等,注意把握推断题的关键点和题中重要信息,积累基础知识,以及知识的综合利用.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.
某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g)?2C(g)△H<0,达到平衡后,只改变反应的一个条件,测得容器中物质的浓度随时间变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸、纯碱、石膏 | B. | 盐酸、烧碱、胆矾 | ||
| C. | HNO3、乙醇、氯化钠 | D. | H3PO4、熟石灰、苛性钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取盐酸体积/ml | 应选用容量瓶的规格/ml | 除容量瓶外还需要的其它仪器 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/ (mol•L-1) | 0.44 | 0.6 | 0.6 |
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com