
【题目】在密闭容器中进行反应:X2(g)+Y2(g)![]() 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A. Z为0.3 mol·L-1 B. Y2为0.4 mol·L-1
C. X2为0.2 mol·L-1 D. Z为0.4 mol·L-1
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列判断正确的是
A.常温下,pH=1的盐酸溶液中,由水电离的H+个数为10-13NA
B.标准状况下,氧原子总数为0.2NA的CO2和NO2的混合气体,其体积为2.24L
C.常温下,5.6g铁分别与足量氯气和浓硝酸反应,转移的电子数目均为0.3NA
D.100g46%乙醇溶液中所含O-H数目为7NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,电解质溶液中的下列关系式不正确的是
A.已知A+H2B(过量)![]() HA+HB,则结合H+的能力:HB<A<B2
HA+HB,则结合H+的能力:HB<A<B2
B.在0.1 molL1的氨水中滴加0.1 molL1盐酸,恰好完全中和时溶液的pH=a,则由水电离产生的c(OH)=10a molL1
C.将c molL1的醋酸溶液与0.02 molL1NaOH溶液等体积混合后溶液恰好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=![]()
D.将0.2 mol·L1盐酸与0.1 mol·L1的KAlO2溶液等体积混合,溶液中离子浓度由小到大的顺序:
c(Cl)>c(K+)>c(Al3+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量的说法不正确的是
A. 物质的量是国际单位制中的一个基本物理量
B. 物质的量可以用符号n表示
C. 摩尔是联系宏观世界和微观世界的重要物理量
D. lmolO3含有的臭氧分子数约6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是 (填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

回答下列问题:
①在步骤i中产生的有毒气体可能有_____________。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032,此时理论上将Al3+沉淀完全,则溶液的pH为______。
③步骤iv中,生成FeCO3的离子方程式是_______________________________。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式 。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释 。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
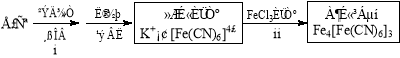
复分解反应ii的离子方程式是 。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN,方案如下:
![]()
若试纸变蓝则证明食品中含有CN,请解释检测时试纸中FeSO4的作用 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为 。
②实验室制Cl2时,装置B中盛放的试剂为 ,其作用是 。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。

①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为 。
②装置D中的现象为 。
③装置E中无水氯化钙的作用为 。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是 。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为 。
②吸收塔内发生反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于金属钠的性质和用途的描述中体现了它的强还原性的是
A. 钠可以用刀切割 B. 钠可以保存在煤油中
C. 钠可以用于冶炼金属钛 D. 钾钠合金用于核反应堆的导热剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)2Z(g)、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是( )

A. 反应①的正反应是吸热反应
B. 达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C. 达平衡(Ⅰ)时,X的转化率为![]()
D. 在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)亚硝酸钠(NaNO2)是一种常见的食品添加剂。某兴趣小组用如图所示装罝制备NaNO2并对其性质作如下探究(A中加热装罝已略去)。

查阅资料可知:
① 2NO+Na2O22NaNO2;2NO2+Na2O22NaNO3。
② NO能被酸性KMnO4氧化成![]() 。
。
③ 在酸性条件下,NaNO2能将I氧化为I2;![]() 能将I2还原为I ,即I2+2
能将I2还原为I ,即I2+2![]() 2I+
2I+![]() 。
。
(1)装置中仪器a的名称为 ,A中反应的化学方程式是 。
(2)装置B中观察到的主要现象是 。
(3)装置C中盛放的试剂是 。
(4)装置E的作用是_______________。
(5)A中滴入浓硝酸之前,应先通入N2一段时间,原因是 。
(6)为测定所得NaNO2的纯度,准确称取m g NaNO2样品放入锥形瓶中并加入适量水溶解,再加入过量KI溶液并滴入几滴淀粉溶液,然后滴加稀硫酸,用c mol/L Na2S2O3溶液滴定至终点,重复操作2~3次,平均消耗Na2S2O3 V mL。滴定终点的现象是 。该样品中NaNO2的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com