
| A. | 1 L 0.1 mol•L-1 CH3COOH溶液中含有的CH3COO-为0.1NA | |
| B. | 常温下,1 L 0.1 mol•L-1 NH4NO3溶液中含有的氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3mol I2,同时转移的电子数为6NA | |
| D. | 常温常压下,22.4 L乙烯中含有的共用电子对的数目为6NA |
分析 A、醋酸是弱酸存在电离平衡;
B、1L0.1mol/L的NH4NO3溶液中含有溶质硝酸铵0.1mol,0.1mol硝酸铵中含有0.2mol氮原子;
C、在反应KIO3+6HI═KI+3I2+3H2O中,反应中元素化合价变化计算电子转移;
D、根据气体摩尔体积的应用条件分析判断,标准状况下气体摩尔体积为22.4L/mol.
解答 解:A、醋酸是弱酸存在电离平衡,1 L 0.1 mol•L-1 CH3COOH溶液中含有的CH3COO-小于0.1NA ,故A错误;
B、1L0.1mol/L的NH4NO3溶液中含有溶质硝酸铵的物质的量为0.1mol,0.1mol硝酸铵中含有0.2mol氮原子,含有的氮原子数为0.2NA,故B正确;
C、在反应KIO3+6HI═KI+3I2+3H2O中,碘元素化合价+5价和-1价变化为0价,电子转移5mol,生成3mol碘单质,每生成3mol I2转移的电子数为5NA,故C错误;
D、常温常压下,22.4 L乙烯不是1mol,含有的共用电子对的数目不一定为6NA,故D错误;
故选B.
点评 本题考查了考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意标准状况下气体摩尔体积为22,.4L/mol,阿伏加德罗常数是历年高考的“热点”问题,这是由于它既考查了学生对物质的量、粒子数、质量、体积等与阿伏加德罗常数关系的理解,又可以涵盖多角度的化学知识内容


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | IA族与 VIIA族元素间可形成共价化合物或离子化合物 | |
| B. | 同主族元素的非金属性越强,其简单阴离子还原性越强 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 第二周期元素的最高价从左到右,由+1递增到+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
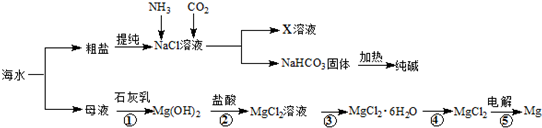
| A. | 电解MgCl2饱和溶液可制得金属镁 | |
| B. | 用浓硫酸与铁反应能增大生成H2的速率 | |
| C. | 电解饱和食盐水的过程中,水的电离平衡正向移动 | |
| D. | 纯银器在空气中露置其表面因电化学腐蚀渐渐变暗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤、石油、天然气都是化石燃料,都是非再生能源,都是一级能源 | |
| B. | 电能、水煤气、氢气都是二级能源,要靠其他能源才能制取 | |
| C. | 利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护环境 | |
| D. | 凡含有食品添加剂的食物对人体均有害,不可食用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 生产过程 | 化学反应 | 反应情况 |
| 硫铁矿的煅烧 | 4FeS2+11O2$\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2 | 4%的硫元素损失而混入炉渣 |
| 催化氧化 | 2SO2+O2$?_{△}^{催化剂}$2SO3 | SO2转化率为90% |
| SO3的吸收 | SO3+H2O=H2SO4 | SO3吸收率为100% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称量样品→加热→冷却→称量CuO | |
| B. | 称量样品→加热→冷却→称量Cu(NO3)2 | |
| C. | 称量样品→加NaOH→过滤→加热→冷却→称量CuO | |
| D. | 称量样品→加热→用已知质量的无水氯化钙吸收水蒸气并称量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
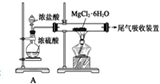 ,其中装置A的作用是制备干燥的HCl气体
,其中装置A的作用是制备干燥的HCl气体查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磷对人无毒,除去与否无关紧要 | |
| B. | 含磷的污水是很好的肥料,不必除去 | |
| C. | 含磷污水排到自然水中,引起藻类繁殖,使水变质,必须除去 | |
| D. | 磷是生物的营养元素,不必除去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com