
【题目】室温下,Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.1×10-15。不考虑溶液混合引起的体积变化和H2S的挥发,室温时下列指定溶液中微粒物质的量浓度关系正确的是( )
A.0.1mol·L-1NaHS溶液:c(Na+)>c(HS-)>c(H2S)>c(S2-)
B.0.1mol·L-1Na2S溶液:c(OH-)=c(H+)+c(HS-)+c(H2S)
C.0.2mol·L-1NaHS溶液和0.1mol·L-1NaOH溶液等体积混合:c(HS-)+3c(H2S)>c(S2-)
D.向0.1mol·L-1NaOH溶液中通入H2S至溶液呈中性:c(Na+)=c(HS-)+c(S2-)
【答案】AC
【解析】
A.由题意得,H2S的电离常数:![]() =1.3×10-7,
=1.3×10-7,![]() =7.1×10-15,HS-的水解平衡常数为:
=7.1×10-15,HS-的水解平衡常数为:![]() ,Kh>Ka2,所以HS-的水解大于电离。NaHS溶液中,NaHS=Na++HS-,HS-发生水解和电离,故c(Na+)>c(HS-);H2S由HS-水解生成,故c(HS-)>c(H2S);由于HS-的水解大于电离,所以c(H2S)>c(S2-);综上所述,c(Na+)>c(HS-)>c(H2S)>c(S2-),A正确;
,Kh>Ka2,所以HS-的水解大于电离。NaHS溶液中,NaHS=Na++HS-,HS-发生水解和电离,故c(Na+)>c(HS-);H2S由HS-水解生成,故c(HS-)>c(H2S);由于HS-的水解大于电离,所以c(H2S)>c(S2-);综上所述,c(Na+)>c(HS-)>c(H2S)>c(S2-),A正确;
B.0.1mol·L-1Na2S溶液中,由质子守恒可得:c(OH-)=c(H+)+c(HS-)+2c(H2S),B错误;
C.0.2mol·L-1NaHS溶液和0.1mol·L-1NaOH溶液等体积混合,由电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),由物料守恒得:2c(Na+)=3[c(S2-)+c(HS-)+c(H2S)],两式联立得:c(S2-)+2c(OH-)=c(HS-)+3c(H2S)+2c(H+),混合液显碱性,有c(H+)<c(OH-),所以c(HS-)+3c(H2S)>c(S2-),C正确;
D.由电荷守恒得:c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),溶液为中性,c(H+)=c(OH-),所以c(Na+)= c(HS-)+2c(S2-),D错误;
故选AC。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的局部X、Y、Z、W均为短周期元素,其原子序数之和为47:
X | |||||
Y | Z | W |
(1)X、Y、Z、W的元素符号依次为_______、________、_______、__________(以下所有问题均用元素符号回答);
(2)X和Y的化合物中的两种微粒均达到了8电子稳定结构,该化合物的电子式为_____;将该化合物的固体溶于足量W的气态氢化物水溶液中,生成两种盐该反应的离子方程式为______________,生成的两种盐的电子式为__________、_____________;
(3)Z的氧化物为_________(填酸性、碱性、两性、不成盐)氧化物,Y、Z、W的最高价氧化物对应的水化物两两之间反应的化学方程式为:![]() __________________________________;
__________________________________;![]() ___________________________;
___________________________;![]() ________________________.
________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CH3CH=CH2+HBr→CH3CHBrCH3,1mol某烃A充分燃烧后可以得到8molCO2和4molH2O。该烃A在不同条件下能发生如图所示的一系列变化。

(1)A的化学式:____________,A的结构简式:__________。
(2)上述反应中,①是__________反应,⑥是__________反应(填反应类型)。
(3)写出 C、D、E 物质的结构简式:C ___________; D _________; E __________。
(4)写出 D→F反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
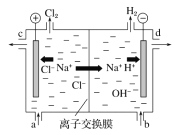
【题目】氯碱工业以电解精制饱和食盐水的方法制取氯气、氢气、烧碱和氯的含氧酸盐等系列化工产品。下图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。完成下列填空:
(1)写出电解饱和食盐水的离子方程式________________。
(2)离子交换膜的作用为____________________。
(3)精制饱和食盐水从图中________位置补充,氢氧化钠溶液从图中________位置流出。(选填“a”、“b”、“c”或“d”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同质量的氢气、甲烷(CH4)、水,其中含分子数最多的是________;等物质的量的三种物质含氢原子最多的是________。
(2)某气体氧化物的化学式为RO2,在标准状况下,0.92 g该氧化物的体积为448 mL,则该氧化物的物质的量为______,该氧化物的摩尔质量为______。
(3)某化学兴趣小组对某品牌矿泉水进行检测时,发现1.0 L该矿泉水中含有45.6 mg Mg2+,Mg2+的物质的量浓度为______。
(4)现有0.1 mol·L-1 Na2SO4和0.3 mol·L-1 H2SO4的混合溶液100 mL,向其中逐滴加入0.2 mol·L-1的Ba(OH)2溶液,并不断搅拌,使反应充分进行。(忽略混合过程中的体积变化)
①当加入50 mL Ba(OH)2溶液时,所得溶液中SO42-离子的物质的量浓度为________mol·L-1。
②当溶液中沉淀量达到最大时,所加Ba(OH)2溶液的体积为________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将30g MnO2的质量分数为76.6%的软锰矿石与足量的浓度为12 molL-1的浓盐酸完全反应(杂质不参加反应),试计算:
(1)参加反应的浓盐酸的体积的大小(结果保留3位小数)。____________
(2)在标准状况下,生成Cl2的体积的大小________ (结果保留1位小数,已知软锰矿石与浓盐酸反应的化学方程式为MnO2+4HCl(浓) =MnCl2+Cl2↑+2H2O)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠被广泛用于电镀、金的提取以及有机合成中,但含氰废水属于高毒类,必须对其进行处理。
(1)向NaCN溶液中通入CO2能发生反应:NaCN+H2O+CO2=HCN+NaHCO3,说明酸性:HCN__________H2CO3(填“>”或“<”)。
(2)含CN-浓度较低的废水可直接用FeSO4·7H2O处理,得到一种蓝色沉淀M,M的摩尔质量为592 g·mol-1,则M的化学式为___________________。
(3)pH在7.510之间且铜作催化剂的条件下,用SO2-空气处理含氰废水会生成NH3、碳酸氢盐及硫酸盐,已知参与反应的SO2与O2的物质的量之比为1∶1,则该反应的离子方程式为______________。
(4)工业上常用碱性氯化法处理含氰废水,其原理如下图所示:

①第一阶段的中间体CNCl中碳元素的化合价为__________________。
②某工厂含氰废水中NaCN的含量为14.7 mg·L-1,处理10m3这样的废水,理论上需要5 mol·L-1 NaClO溶液____________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2一氨-3—氯苯甲酸是白色晶体,其制备流程如下:

已知:
回答下列相关问题
(1)![]() 的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
的名称是__________,2-氨-3-氯苯甲酸中含N官能团的电子式为__________。
(2)反应①中R代表的是_____________,反应②的反应类型为_____________。
(3)如果反应③中KMnO4的还原产物为MnSO4,请写出该反应的化学方程式_____________。
(4)A的结构简式为_____________,⑥的反应条件为_____________。
(5)符合下列条件的同分异构体的结构简式为_____________。
a.式量比![]() 大42的苯的同系物;
大42的苯的同系物;
b.与酸性KMnO4反应能生成二元羧酸
c.仅有3种等效氢
(6)事实证明上述流程的目标产物的产率很低;据此,研究人员提出将步骤⑥设计为以下三步,产率有了一定提高。

分析产率提高的原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com