
已知:HNCO(异氰酸,其结构是H﹣N=C=O)能和NO2反应生成N2、CO2和H2O.下列有关上述反应的叙述不正确的是( )
|
| A. | HNCO中的氮元素被氧化 | B. | NO2中的氮元素被还原 |
|
| C. | 每生成1mol H2O转移6mol电子 | D. | CO2是氧化产物 |
| 氧化还原反应. | |
| 专题: | 氧化还原反应专题. |
| 分析: | 由结构式可知HNCO中H为+1价,N为﹣3价,C为+4价,O为﹣2价,反应中只有N元素的化合价发生变化,根据氧化剂和还原剂得失电子数目相等可知配平后的方程式为8HNCO+6NO2=7N2+8CO2+4H2O,以此解答该题. |
| 解答: | 解:由结构式可知HNCO中H为+1价,N为﹣3价,C为+4价,O为﹣2价,反应中只有N元素的化合价发生变化,根据氧化剂和还原剂得失电子数目相等可知配平后的方程式为8HNCO+6NO2=7N2+8CO2+4H2O,则 A.HNCO中N为﹣3价,反应后N为0价,则HNCO中的氮元素被氧化,故A正确; B.NO2中N为+4价,反应后N为0价,则NO2中的氮元素被还原,故B正确; C.根据方程式可知,生成4mol水转移24mol电子,则每生成1mol H2O转移6mol电子,故C正确; D.反应中只有N元素的化合价发生变化,N2既是氧化产物,又是还原产物,故D错误. 故选D. |
| 点评: | 本题考查氧化还原反应,题目难度不大,注意根据HCNO的结构式判断元素的化合价为解答该题的关键,根据配平后的方程式进行判断. |


科目:高中化学 来源: 题型:
科学家最近又发现了一种新能源——“可燃冰”。它的主要成分是甲烷分子的结晶水合物(CH4·nH2O)。其形成过程是:埋于海底地层深处的大量有机质在缺氧环境中,厌氧型细菌把有机质分解,最后形成石油和天然气,其中许多天然气被包进水分子中,在海底的低温与高压下形成了类似冰的透明晶体,这就是“可燃冰”。这种“可燃冰”的晶体类型是( )
A.离子晶体 B.分子晶体
C.原子晶体 D.金属晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
A.把固体消石灰和固体氯化铵混合加热:OH-+NH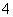
 NH3↑+H2O
NH3↑+H2O
B.将硫化氢气体通入硫酸铜溶液中:S2-+Cu2+===CuS↓
C.在澄清石灰水中通入少量的二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D.氨水中加入盐酸:H++NH3===NH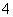
查看答案和解析>>
科目:高中化学 来源: 题型:
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他材料电池,电池总反应为
V2O5+xLi LixV2O5。下列说法中正确的是
LixV2O5。下列说法中正确的是
A.电池在放电时,Li+向负极移动
B.锂在放电时做正极,充电时为阳极
C.该电池充电时阳极的反应为LixV2O5﹣xe-═V2O5+xLi+
D.V2O5只是锂发生反应的载体,不参与电池反应
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用金红石(主要成分TiO2)制金属钛可通过以下反应进行:
①TiO2+2C+2Cl2 TiCl4+2CO ②TiCl4+2Mg
TiCl4+2CO ②TiCl4+2Mg Ti+2MgCl2
Ti+2MgCl2
对于上述两个反应的叙述正确的是( )
|
| A. | 都是置换反应 | B. | 都是氧化还原反应 |
|
| C. | 反应中钛元素都被还原 | D. | 加热时金属钛和氩气(Ar)能反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示对应化学反应的离子方程式正确的是( )
|
| A. | 用白醋除铁锈:Fe2O3+6H+═3H2O+2Fe3+ |
|
| B. | 向NH4HCO3溶液中加入过量的Ba(OH)2溶液并加热:Ba2++2OH﹣+NH4++HCO3+ |
|
| C. | 用过量冷氨水吸收SO2:SO2+NH3•H2O═HSO3﹣+NH4+ |
|
| D. | 用强碱吸收工业制取硝酸尾气:NO+NO2+2OH﹣═2NO3﹣+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
某强氧化剂XO(OH)2+被Na2SO3还原.如果还原2.4×10﹣3mol XO(OH)2+,需用30mL 0.2mol/L的Na2SO3溶液,那么X元素被还原后的价态是( )
|
| A. | +2 | B. | +1 | C. | 0 | D. | ﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
合成聚丙烯腈纤维的单体是丙烯腈,它可以由以下两种方法制备。
方法一:CaCO3 CaO
CaO CaC2
CaC2 CH≡CH
CH≡CH CH2===CH—CN
CH2===CH—CN
方法二:CH2===CH—CH3+NH3+ O2
O2 CH2===CH—CN+3H2O
CH2===CH—CN+3H2O
①方法二比方法一反应步骤少,能源消耗低,成本低 ②方法二比方法一原料丰富,工艺简单 ③方法二比方法一降低了有毒气体的使用,减少了污染 ④方法二需要反应温度高,耗能大
以上叙述对两种方法分析正确的是( )
A.①②③ B.①③④
C.②③④ D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com