
一定温度下,向一个容积为2 L的真空密闭容器中通入1 mol N2和3 mol H2,3 min后,测得容器内的压强是开始时的0.9倍,则这段时间内v(H2)为
A.0.2 mol/(L·min) B.0.6 mol/(L·min) C.0.1 mol/(L·min)  D.0.3 mol/(L·min)
D.0.3 mol/(L·min)
科目:高中化学 来源: 题型:选择题
| A. | 胶体区别于其它分散系的本质特征是分散质的微粒直径在10-9-10-7m之间 | |
| B. | FeCl3溶液是电中性的,Fe(OH)3胶体带正电荷 | |
| C. | 胶体的分散质能通过滤纸空隙 | |
| D. | 树林中晨曦的阳光光束现象与丁达尔现象有关 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年宁夏卫一高一上10月月考化学a卷(解析版) 题型:选择题
甲、乙、丙、丁分别是Na2CO3、AgNO3、BaCl2、盐酸四种无色溶液中的一种,它们两两反应后的现象如下:甲+乙→沉淀;甲+丙→沉淀;乙+丙→沉淀;丙十丁→沉淀;乙+丁→无色无味气体。则甲、乙、丙、丁四种溶液依次是
A.BaCl2、Na2CO3、盐酸、AgNO3
B.Na2CO3、盐酸、AgNO3、BaCl2
C.BaCl2、Na2CO3、AgNO3、盐酸
D.AgNO3、盐酸、BaCl2、Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:填空题
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
编号[ | H | 酸性KMnO4溶液 | 温度/℃ | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.01 | 4.0 | 50 |
(1)该反应的离子方程式为____________________________;
(2)探究温度对化学反应速率影响的实验编号是 ,探究反应物浓度对化 学反应速率影响的实验编号是 ;
学反应速率影响的实验编号是 ;
(3)实验①测得K MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
MnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)= mol·L-1·min-1;
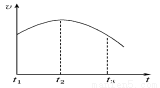
(4)该反应的速率v和时间t的关系如图所示,在t1~t2时段反应速率________(填“加快”或“减慢”或“变化不明显”),主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
一 定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
定条件下,用甲烷可以消除氮的氧化物(NOx)的污染,已知:
①CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(g) ΔH1=-574kJ·mol-1
②CH4(g)+4NO(g) =2N2(g)+CO2(g)+2H2O(g) ΔH2=-1160kJ·mol-1;下列选项正确的是
A.CH4(g)+2NO2(g) =N2(g)+CO2(g)+2H2O(g) ΔH=-867kJ
B.CH4(g)+4NO2(g) =4NO(g)+CO2(g)+2H2O(l) ΔH3>ΔH1
C.若用0.2mol CH4还原NO2至N2,则反应中放出的热量一定为173.4kJ
D.若用标准状况下2.24L CH4还原NO2至N2,整个过程中转移的电子为0.8mol
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
模型法是化学中把微观问题宏观化的最常见方法,对于反应2HBr(g) H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
H2(g)+Br2(g),下列四个图中可以表示该反应在一定条件下为可逆反应的是
A.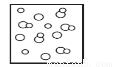 B.
B.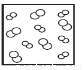 C.
C.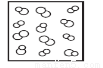 D.
D.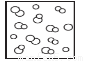
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
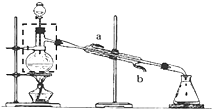 某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:
某实验小组用无水乙醇、乙酸与浓硫酸制取乙酸乙酯并提纯,已知乙醇可以和氯化钙反应生成微溶的CaCl2•6C2H5OH.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
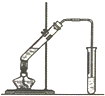 Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.
Ⅰ.乙烯是石油裂解气的主要成分,乙烯的结构简式为H2C=CH2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 | 分子直径/nm | 分子与H2O的结合能E/kJ•mol-1 |
| CH4 | 0.436 | 16.40 |
| CO2 | 0.512 | 29.91 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com