工业上制备BaCl
2的工艺流程图如下:
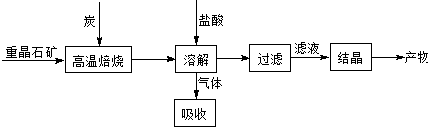
某研究小组在实验室用重晶石(主要成分BaSO
4)对工业过程进行模拟实验.查表得
BaSO
4(s)+4C(s)
4CO(g)+BaS(s)△H
1=+571.2kJ?mol
-1 ①
BaSO
4(s)+2C(s)
2CO
2(g)+BaS(s)△H
2=+226.2kJ?mol
-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠.一定浓度的硫化钠溶液因向空气中释放臭味而称为“臭碱”,下列对这一现象的解释你认为最合理的是
(填序号)
A.硫化钠在水溶液中水解生成了NaOH和H
2S气体
B.硫化钠溶液因吸收空气中的氧气被氧化生成了NaOH,同时生成有臭味的气体
C.硫化钠溶液水解的过程中因吸收空气中的CO
2而放出H
2S气体
(2)向同物质的量浓度BaCl
2和KBr混合溶液中逐滴加入AgNO
3溶液,先生成
沉淀,当
=
时,开始生成第二种沉淀,随着AgNO
3溶液的进一步滴加,此时生成的沉淀以
为主,且
会
(填变大、变小、始终不变).
[已知K
sp(AgBr)=5.4×10
-13,K
sp(AgCl)=2.0×10
-10]
(3)反应C(s)+CO
2(g)
2CO(g)的△H=
kJ?mol
-1.
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
.




 学习实践园地系列答案
学习实践园地系列答案