
【题目】钛酸锌(ZnTiO3)是一种抗菌涂料,应用于人造骨骼等生物移植技术。回答下列问题:
(1)基态Zn原子的电子占据能量最高的能层符号为_____________,与Zn同周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有___________种
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。则电负性C____B(选填“>或“<”);第一电离能N>O,原因是__________________________________________。
(3)ZnTiO3与80%H2SO4反应可生成TiOSO4。
①![]() 的空间构型为_____________,其中硫原子采用____________杂化。
的空间构型为_____________,其中硫原子采用____________杂化。
②与![]() 互为等电子体的分子的化学式为_________________(任写一种即可)
互为等电子体的分子的化学式为_________________(任写一种即可)
(4)Zn与S所形成化合物晶体的晶胞如图所示。
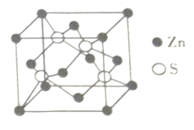
①与Zn原子距离最近的Zn原子有___________个。
②该化合物的化学式为_________________________________。
③已知该晶体的晶胞参数为a×10-12m,阿伏加德罗常数为NA。则该晶体的密度为__________________g/cm3(列式即可)
【答案】N 4 > N原子中2p轨道处于半充满状态,比较稳定,故第一电离能N>O 正四面体形 sp3 CCl4、SiCl4、SO2Cl2(任写一种即可) 12 ZnS ![]()
【解析】
(1)Zn位于周期表第四周期,基态Zn原子的核外电子,占据的能量最高的能层为第4层,符号为N;与Zn同位于第四周期的所有副族元素的基态原子中,最外层电子数与Zn相同的元素有Sc、Ti、V、Mn四种,故答案为:N;4;
(2)同周期元素,从左至右,原子半径逐渐减小,原子核对外层电子的吸引力逐渐增强,电负性逐渐增强,所以电负性C>B;N的核外电子排布为[He]2s22p3,2p轨道处于半充满状态,比较稳定,O的核外电子排布为[He]2s22p4,不是稳定结构,所以第一电离能N>O,故答案为:>;N原子中2p轨道处于半充满状态,比较稳定,故第一电离能N>O;
(3)①SO42-的中心原子S的价层电子对数=4+![]() ×(8-4×2)=4,VSEPR模型为正四面体形,没有孤电子对,所以SO42-的空间构型为正四面体形,S原子的杂化方式为sp3,故答案为:正四面体形;sp3;
×(8-4×2)=4,VSEPR模型为正四面体形,没有孤电子对,所以SO42-的空间构型为正四面体形,S原子的杂化方式为sp3,故答案为:正四面体形;sp3;
②与SO42-互为等电子体的分子需满足:与SO42-原子总数相同(5个)、价电子总数相同(32个),如:CCl4、SiCl4、SO2Cl2等,故答案为:CCl4、SiCl4、SO2Cl2(任写一种即可);
(4)①Zn原子位于晶胞的顶点和面心上,与Zn原子距离最近的Zn原子有12个,故答案为:12;
②一个晶胞中Zn原子的个数=8×![]() +6×
+6×![]() =4,S原子的个数=4,二者的个数比为1:1,所以该化合物的化学式为ZnS,故答案为:ZnS;
=4,S原子的个数=4,二者的个数比为1:1,所以该化合物的化学式为ZnS,故答案为:ZnS;
③ =
= 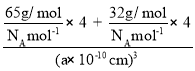 =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


 培优三好生系列答案
培优三好生系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,反应N2+3H2![]() 2NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内NH3的化学反应速率为
2NH3在10L恒容密闭容器中进行,测得2min内,H2的物质的量由20mol减少到8mol,则2min内NH3的化学反应速率为
A.0.4mol·(L·min)1B.1.8mol·(L·min)1
C.1.2mol·(L·min)1D.0.6mol·(L·min)1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl固体溶于水,溶解过程如图所示,下列说法正确的是
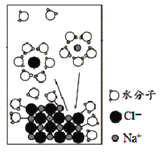
A.该过程发生了分解反应
B.离子从固体表面脱离后不会再回到固体表面
C.水合Na+的图示不科学
D.NaCl溶于水后发生了电离,是在通电条件下进行的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拉曼光谱证实,AlO2-在水中转化为[Al(OH)4]-。将一定量的Na2CO3、NaAlO2固体混合物溶于适量水中,再逐滴加入1mol/L盐酸,测得溶液中CO32-、HCO3-、[Al(OH)4]-、Al3+的物质的量与加入盐酸的体积变化关系如图所示,则下列说法正确的是
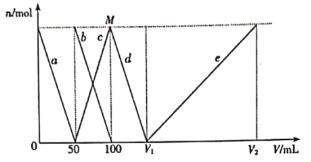
A.CO32-、HCO3-和[Al(OH)4]-在水溶液中可大量共存
B.d线表示的反应为:[Al(OH)4]-+H+=Al(OH)3↓+H2O
C.原固体混合物中CO32-与AlO2-的物质的量之比为1:1
D.V1=150mL,V2=300mL;M点生成的CO2为0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用氯氧化法处理含氰(CN-)废水,一定条件下,氯气和CN-反应生成无毒气体N2和CO2。下列说法不正确的是( )
A.CN-中碳元素的化合价为+2B.该反应的氧化产物是N2
C.反应中氧化剂和还原剂的系数比为5:2D.该反应的还原产物为Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:
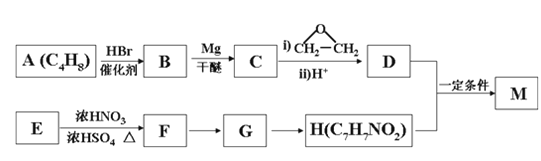
已知以下信息:①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
②RX![]() RMgX
RMgX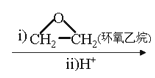 RCH2CH2OH。
RCH2CH2OH。
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是_____________________。
(2)由E生成F的化学方程式为_________________________________________。
(3)由G生成H的反应类型为__________________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式_______________________________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_____种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图装置中发生反应的离子方程式为:Zn+2H+=Zn2++H2↑,下列说法错误的是
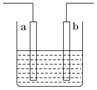
A. a、b不可能是同种材料的电极
B. 该装置可能是电解池,电解质溶液为稀盐酸
C. 该装置可能是原电池,电解质溶液为稀盐酸
D. 该装置可看作是铜-锌原电池,电解质溶液是稀硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,用0.01molL-1NaOH溶液滴定10mL0.01molL-1H2A溶液的滴定曲线如图所示(已知:25℃时,H2A的Ka1=10-1.75,Ka2=10-7.19)。下列说法不正确的是( )
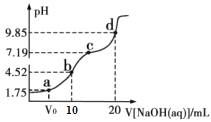
A.a点所得溶液中:V0=5mL
B.B点所得溶液中:c(H2A)+c(H+)= c(A2-)+c(OH-)
C.C点所得溶液中:c(Na+)>3 c(HA-)
D.D点所得溶液中A2-水解平衡常数Kh1=10-6.81
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含铜污泥[主要成分为Cu(OH)2、Cu2(OH)2CO3、Fe(OH)3和SiO2]为原料制备纯净的Cu2(OH)2CO3的工艺流程如下:
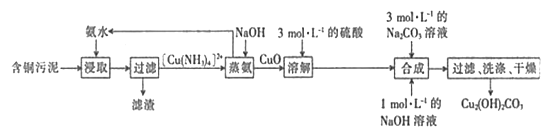
回答下列问题:
(1)为提高浸取率采取的措施是____(填字母)。
a.增大浸取与含铜污泥的投料比 b.减小氨水的浓度
c.缩短浸取的时间 d.适当提高浸取的温度
(2)合成Cu2(OH)2CO3时发生的离子方程式为__________。
(3)第一次过滤时所得滤渣的成分为________(填化学式)。
(4)经检测,该含铜污泥中铜的含量为32%,且上述工艺流程中铜的损耗率为10%,某工厂以20t这种含钢污泥为原料,经上述工艺流程后,最终可制得Cu2(OH)2CO3____t。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com