
用如图装置,完成很多电化学实验。下列有关此装置的叙述中,不正确的
是( )
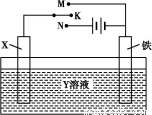
A.若X为锌棒,Y为NaCl溶液,开关K置于M处,可减缓铁的腐蚀,这种方法称为牺牲阳极的阴极保护法
B.若X为碳棒,Y为NaCl溶液,开关K置于N处,可减缓铁的腐蚀,溶液中的阳离子向铁电极移动
C.若X为铜棒,Y为硫酸铜溶液,开关K置于M处,铜棒质量将增加,此时外电路中的电子向铜电极移动
D.若X为铜棒,Y为硫酸铜溶液,开关K置于N处,铁棒质量将增加,溶液中铜离子浓度将减小
科目:高中化学 来源:2014高考化学名师知识点精编 专题18烃及其有机物的命名练习卷(解析版) 题型:选择题
关于苯乙烯(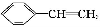 )的下列叙述中,正确的是( )
)的下列叙述中,正确的是( )
A.分子中所有原子一定在同一平面内
B.不能使KMnO4酸性溶液褪色
C.不能使溴的CCl4溶液褪色
D.可通过加聚反应生成高分子化合物
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题14无机非金属材料-碳和硅练习卷(解析版) 题型:选择题
取一定量的NaOH溶液通入CO2后,再继续向该溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,下列有关说法正确的是( )
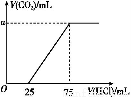
A.原溶液中NaOH的物质的量为0.75 mol
B.通入CO2后所得的溶液溶质成分为NaOH和Na2CO3
C.通入CO2后所得的溶液中含有2.5×10-3 mol NaHCO3
D.纵坐标中a的数值为224
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法正确的是( )
A.该合金的熔点介于钠、铝之间
B.钠或铝形成的氧化物均为碱性氧化物
C.钠和铝分别与不足量的盐酸反应所得溶液均呈中性
D.若合金中n(Na)>n(Al),将其投入到适量的水中可得无色透明溶液
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题12钠、铝及其重要化合物练习卷(解析版) 题型:选择题
下列关于钠与水反应的说法不正确的是( )
①将小块钠投入滴有石蕊试液的水中,反应后溶液变红
②将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
③将两小块质量相等的金属钠,一块直接投入水中,另一块用铝箔包住,在铝箔上刺些小孔,然后投入水中,两者放出的氢气质量相等
A.只有①② B.只有③ C.只有②③ D.①②③
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题11电化学练习卷(解析版) 题型:选择题
关于下列各装置图的叙述中,不正确的是( )
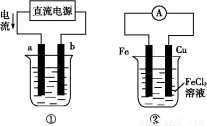
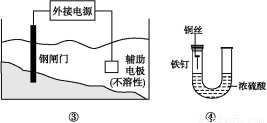
A.用装置①精炼铜,则a极为精铜,电解质溶液为CuSO4溶液
B.装置②的总反应是:Fe+2Fe3+=3Fe2+
C.装置③中钢闸门应与外接电源的负极相连
D.装置④中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题10盐类水解与沉淀溶解平衡练习卷(解析版) 题型:选择题
某温度时,Ag2SO4在水中的沉淀溶解平衡曲线如图所示。该温度下,下列说法正确的是( )
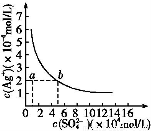
A.含有大量S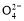 的溶液中肯定不存在Ag+
的溶液中肯定不存在Ag+
B.0.02 mol·L-1的AgNO3溶液与0.02 mol·L-1的Na2SO4溶液等体积混合不会生成沉淀
C.Ag2SO4的溶度积常数(Ksp)为1×10-3
D.a点表示Ag2SO4的不饱和溶液,蒸发可以使溶液由a点变到b点
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题9电化学原理练习卷B(解析版) 题型:选择题
镁及其化合物一般无毒(或低毒)、无污染,且镁电池放电时电压高而平稳。其中一种镁电池的反应为xMg+Mo3S4 MgxMo3S4。下列说法错误的是( )
MgxMo3S4。下列说法错误的是( )
A.放电时Mg2+向正极迁移
B.放电时正极反应为Mo3S4+2xe-=Mo3S42x-
C.充电时Mo3S4发生氧化反应
D.充电时阴极反应为Mg2++2e-=Mg
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮复习限时集训 专题8电解质溶液练习卷A(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述正确的是( )
H++OH-,下列叙述正确的是( )
A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小
C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,促进水的电离平衡
D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com