
【题目】某温度下,在一容积可变的密闭容器里,反应 2A(g)B(g)+2C(g)达到平衡时,A、B 和 C 的物质的量分别为 4mol、2mol、4mol。在保持温度和压强不变的条件下,下列说法正确的是( )
A.充入 1mol 稀有气体氦(He),平衡将不发生移动
B.充入A、B、C 各 1mol,平衡将向正反应方向移动
C.将 A、B、C 各物质的物质的量都减半,C 的百分含量不变
D.加入正催化剂,正逆反应速率均加快,平衡向逆反应方向移动
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 氮原子的价电子排布图:![]()
B. 2p和3p轨道形状均为哑铃形,能量也相等
C. 价电子排布为4s24p3的元素位于第四周期第ⅤA族,是p区元素
D. 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、R、X、Y、Z五种元素的原子序数依次递增。已知:①Z的原子序数为29,其余的均为短周期主族元素;Y原子的价电子(外围电子)排布为msnmpn;②R原子核外L层电子数为奇数;③Q、X原子p轨道的电子数分别为2和4。请回答下列问题:
(1)Z2+的核外电子排布式是________。
(2)在[Z(NH3)4]2+离子中,Z2+的空轨道接受NH3分子提供的________形成配位键。
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是________。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为________(用元素符号作答)。
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为________,其中心原子的杂化类型是________。
(6)某元素原子的价电子构型为3d54s1,该元素属于________区元素,元素符号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X(g)+3Y(g)2Z(g),其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.改变压强,平衡常数不变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度T℃时,在3个1L的恒容密闭容器中发生:C0(g)+H20(g)= C02(g) + H2(g) △H =-41kJmol-1,其起始时投料的方式、各物质的量及其达平衡过程体系热量的变化入下表所示:
容器编号 | 起始各物质物质的量/mol | 达平衡过程体系热量的变化(均为正值) | |||
C0 | H20(g) | C02 | H2 | ||
① | 1 | 4 | 0 | 0 | 32.8kJ |
② | 8 | 2 | 0 | 0 | Q1 |
③ | 0 | 0 | 1 | 4 | Q2 |
下列说法中正确的是
A. 若经过10s容器①中反应达到平衡,则v(CO)=0.08molL-1s-1
B. 容器②和容器③中热量变化:Q2=Q1=32.8kJ
C. 若加入催化剂,改变了该反应的途径,反应的△H也随之改变
D. 保持相同条件,向平衡后的容器①中再加入0.2molCO(g)和0.8molCO2(g) ,则平衡不发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向 0.01 mol·L-1 的醋酸溶液中滴入 pH=7 的醋酸铵溶液,溶液 pH 随滴入醋酸铵溶液体积变化的曲线示意图如图所示。下列分析正确的是
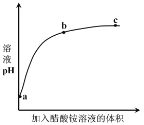
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,pH的增大仅是因为醋酸电离平衡逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应aA(g)+bB(g)cC(g) ΔH<0在等容条件下进行。改变其它反应条件,在I、II、III阶段体系中各物质浓度随时间变化的曲线如图所示,下列说法不正确的是
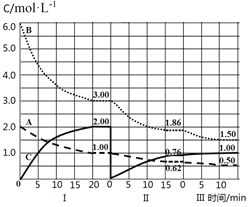
A.反应的化学方程式中,a:b:c=1:3:2
B.第II阶段反应温度小于第III阶段反应温度
C.A的平均反应速率vⅠ(A)、vⅡ(A)、vⅢ(A),最大的是vⅠ(A)
D.由第一次平衡到第二次平衡,采取的措施是从反应体系中移走C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素M、W、X、Y、Z的原子序数依次增大,M与W形成的一种化合物是生活中的常见的清洁能源,Y的原子半径是所有短周期主族元素中最大的,由X、Y和Z三种元素形成的一种盐溶于水后,加入稀盐酸,有淡黄色沉淀析出,同时有刺激性气体产生,回答下列问题:
(1)Y元素是____________(元素名称),X在周期表的位置为:__________。
(2)Y2Z2的电子式: ________________。
(3)X、Y、Z形成的盐与盐酸反应,有淡黄色沉淀析出,同时有刺激性气体产生的离子方程式:______________。
(4)Y2Z溶液的pH>7,其原因是(用离子方程式表示):__________________________。
(5)M2、WX的混合气体与空气构成碱性(KOH为电解质)燃料电池,若WX和M2体积比为1:2,W元素仅转化成MWX3-。负极总反应的电极反应式为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com