
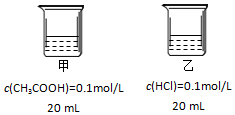
| A. | 甲、乙两烧杯中水电离出的H+浓度:甲<乙 | |
| B. | 分别稀释相同倍数,溶液pH变化:甲=乙 | |
| C. | 相同条件下,AgCl(s)在甲中溶解度大于在乙中 | |
| D. | 向甲烧杯加入NaOH使溶液中性后一定存在:c(Na+)=c(CH3COO-)+c(CH3COOH) |
分析 A.溶液的酸性越强,则对水的电离抑制程度越大;
B.加水稀释,弱电解质的电离平衡被促进;
C.乙中含有的氯离子对AgCl的溶解平衡有抑制作用;
D.根据电荷守恒判断.
解答 解:A.溶液的酸性越强,则对水的电离抑制得越厉害,由于乙烧杯中含有强电解质HCl,故乙烧杯中的酸性比甲强,则对水的电离的抑制更强,即乙中水的电离程度更小,水电离出H+浓度:甲>乙,故A错误;
B.加水稀释,弱电解质的电离平衡被促进,故甲中氢离子浓度下降较乙中的慢,则pH变化甲<乙,故B错误;
C.乙中含有的氯离子对AgCl的溶解平衡有抑制作用,故相同条件,AgCl(s)在甲中溶解度大于在乙中,故C正确;
D.向甲烧杯加入NaOH使溶液中性,溶液中存在电荷守恒:c(H+)+c(Na+)=c(CH3COO-)+c(OH-),由于溶液显中性,即c(H+)=c(OH-),所以溶液中c(Na+)=c(CH3COO-),故D错误.
故选C.
点评 本题考查了弱电解质的电离平衡的移动和溶解平衡的移动等问题,综合性较强,难度适中,注意加水稀释对弱电解质的电离平衡的影响,侧重于考查学生的分析能力和应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
 羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:
羰基硫与烧碱溶液反应生成水和两种正盐的离子方程式为COS+4NaOH=Na2S+Na2CO3+2H2O羰基硫的脱硫常用两种方法,其反应式分别为:| 化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
| 键能(kJ/mol) | 803 | 742 | 577 | 339 | 465 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | mmolCO2、3mmolH2、 nmolCH3OH(g)、nmolH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氧化碳和二氧化碳都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ | |
| B. | 含有大量Fe3+的溶液中:Na+、Mg2+、I-、SCN- | |
| C. | pH=13的溶液中:K+、NH4+、SO42-、NO3- | |
| D. | 由水电离产生的c(OH-)=1×10-12mol•L-1的溶液中:K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ①④⑥⑧ | C. | ①④⑥⑨ | D. | ①④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①中MnO2和H2SO4都是氧化剂 | B. | 硫酸在该生产中可循环使用 | ||
| C. | ①中析出16gS时转移1mol电子 | D. | ②中MnSO4发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
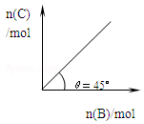 在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是
在盛有足量A的体积可变的密闭容器中,保持压强一定,加入B,发生反应:A(s)+2B(g)?4C(g)+D(g);△H<0.在一定温度、压强下达到平衡.平衡时C的物质的量与加入的B的物质的量的变化关系如图.下列说法正确的是| A. | ①③ | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com