
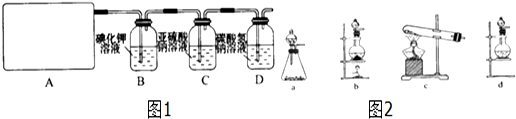
 实验室用如图所示装置制取乙烯.
实验室用如图所示装置制取乙烯.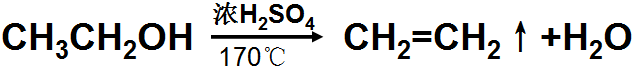
分析 (1)仪器A为圆底烧瓶;
(2)在浓硫酸、加热170℃,乙醇发生消去反应,生成乙烯和水;
(3)乙烯不溶于水,密度和空气相近;
(4)乙烯在空气中燃烧,火焰明亮且伴有黑烟.
解答 解:(1)仪器A的名称是圆底烧瓶,故答案为:圆底烧瓶;
(2)在浓硫酸、加热170℃,乙醇发生消去反应,生成乙烯和水,方程式为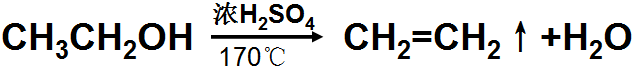 ;
;
故答案为: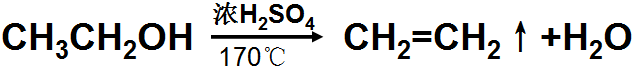 ;
;
(3)由于乙烯密度和空气接近,不溶于水,采用排水法收集,故答案:排水法;
(4)在导管口点燃乙烯,乙烯在空气中燃烧,火焰明亮且伴有黑烟,生成二氧化碳和水,故答案为:乙烯在空气中燃烧,火焰明亮且伴有黑烟.
点评 本题考查乙烯的实验室制法,注意由于乙烯密度和空气接近,不能采用排空法,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 反应的△H>0 | B. | 降低温度,平衡向逆反应方向移动 | ||
| C. | 反应的△H<0 | D. | 升高温度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
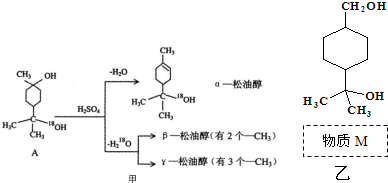
 .
.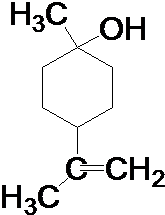 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
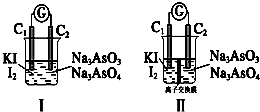
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 36:60 | B. | 60:36 | C. | 1:2 | D. | 1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com