
【题目】通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;B溶于A后所得的物质与E微粒反应后可得C和一种白色沉淀。请回答:
(1)A的结构式为______________。
(2)B的电子式为______________。
(3)D的电子式为______________。
(4)B溶于A后所得的物质与E微粒反应后可得C和一种白色沉淀,写出该反应的离子方程式____________________________(写一个即可)。
【答案】H—O—H ![]()
![]() Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+或Al3++3NH3·H2O=Al(OH)3↓+3NH4+
Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+或Al3++3NH3·H2O=Al(OH)3↓+3NH4+
【解析】
常见的10电子分子有H2O、NH3、CH4、HF等,常见的10电子阳离子有Na+、Mg2+、Al3+、NH4+、H3O+,常见的10电子阴离子有F-、OH-,根据“B溶于A后所得的物质可电离出C和D”,可推出A为H2O、B为NH3、C为NH4+、D为OH-,再根据A、B、E反应后可得C和一种白色沉淀,可推出E为Mg2+或Al3+,以此解答。
(1)A为H2O,属于共价化合物,结构式为H-O-H;
(2) B为NH3,属于共价化合物,电子式为![]() ;
;
(3)D为OH-,电子式为![]() ;
;
(4)A为H2O、B为NH3,E为Mg2+或Al3+,B溶于A后所得的物质为一水合氨,与E微粒反应后可得C和一种白色沉淀,该反应的离子方程式Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+或Al3++3NH3·H2O=Al(OH)3↓+3NH4+。


科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的的是
A.除去淀粉溶液中的NaCl 
B.比较NaHCO3和Na2CO3的热稳定性
C.制备Fe(OH)2 
D.测定过氧化钠的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请根据要求书写出方程式。
(1)NO2与水形成酸雨的化学方程式为______________________________。
(2)1754年,Briestly用硵砂(主要成份NH4Cl)和熟石灰共热制得了氨,化学反应方程式为______________________________。
(3)Ertl(获2007年诺贝尔化学奖)对合成氨机理进行深入研究,并将研究成果用于汽车尾气处理中,在催化剂存在下可将NO和CO反应转化为两种无色无毒气体,用化学反应方程式表示这个过程_________________________________。
(4)可利用CH4等气体除去烟气中的氮氧化物,生成物为可参与大气循环的气体,请写出CH4与NO反应的化学方程式_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烷的分子结构也可用键线式表示为:![]() ,有机物A的键线式为
,有机物A的键线式为![]() ,A可由有机物B与等物质的量氢气通过加成反应得到。
,A可由有机物B与等物质的量氢气通过加成反应得到。
(1)有机物A的分子式为___________。
(2)有机物A的名称是_______________。
(3)在A 的主链为5个C原子的所有同分异构体中,其分子结构中含有3个甲基的有机物的名称是_______________。
(4)有机物B可能的结构简式有![]() 、_______________、_______________、_______________、_______________。
、_______________、_______________、_______________、_______________。
(5)请写出![]() 在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
在一定条件下,发生加聚反应的化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2.8g铁粉加入50mL3mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁粉有剩余,溶液呈浅绿色
B.往溶液中滴入KSCN溶液,不显血红色
C.氧化产物和还原产物的物质的量之比为2∶1
D.Fe2+和Fe3+物质的量之比为3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为从海带中提取碘的工业生产过程图,按照要求回答问题:

(1)海水中碘的总藏量很大,目前工业上___(填“直接”或“不直接”)用海水提取碘。
(2)工业生产过程中通常将干海带粉碎的目的是___。
(3)“滤液”中加入硫酸酸化的离子方程式是___;“氧化”步骤发生反应的离子方程式是___。
(4)生产过程图中“提纯”的方法是___。
(5)下列有关从海带中提取碘的说法错误的是___。
A.“过滤”操作若在实验室进行,需要用到的玻璃仪器有漏斗、烧杯、玻璃棒
B.“碱化”时加入NaOH溶液的主要作用是可溶性有机质在碱性溶液中可形成沉淀
C.现在工业上从海带中提取碘时,也有用离子交换法处理含碘离子的溶液以提高碘的提取率
D.可用淀粉溶液检验“滤液”中的离子是否氧化完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据物质结构相关知识,回答下列问题:
(1)在第三周期的元素中,第一电离能介于Mg与Cl之间的有_____种。
(2)碳元素与氮元素形成的某种晶体的晶胞如图所示,其中8个C原子位于立方体的顶点,4个C原子位于立方体的面心,4个N原子在立方体内。
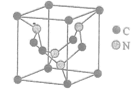
①已知该晶体硬度超过金刚石,其原因是_____。
②晶胞中C原子的杂化方式为_____。
③知该晶胞参数为a nm,阿伏加德罗常数用NA表示,则该晶体的密度为g·cm-3________
(3)大π键可表示为Πmn,其中m代表参与形成的大π键原子数,n表示大π键的电子数,如![]() 的大π键可表示为Π66,则CO32-中的大π键可表示为______。
的大π键可表示为Π66,则CO32-中的大π键可表示为______。
(4)金属铬是一种极硬、耐腐蚀的银白色金属,其化合物种类繁多,如:Cr2(SO4)3、K2Cr2O7以及配离子[Cr(H2O)3(NH3)3]3+等。
①基态铬原子的价电子排布式为_____。
②配离子[Cr(H2O)3(NH3)3]3+的结构可能有种______。
(5)AlP因杀虫效率高、廉价易得而被广泛应用。已知AIP的熔点为2000℃,其晶胞结构如下图所示。
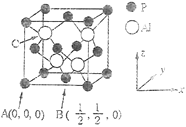
①C点的原子坐标为_____。
②AlP的晶胞中,Al原子位于P原子形成的正四面体空隙中,此空隙的填充率为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com