
浓硫酸具有A.强酸性B.强氧化性C.高沸点.低挥发性D.脱水性E.吸水性等性质。以下过程主要表现了浓硫酸的哪些性质?请将答案的字母分别填入括号中。
(1)热的浓硫酸与铜片等金属反应( )
(2)用磷矿粉[主要成分Ca3(PO4)2]和硫酸反应制磷酸( )
(3)热的浓硫酸分别与木炭和硫粉等反应( )
(4)浓硫酸干燥H2.O2.Cl2.HCl和SO2等气体( )
(5)常温下可以用铁或铝的容器贮存浓硫酸( )
(6)胆矾放在盛浓硫酸的干燥器中变成白色粉末( )
(7)浓硫酸使湿润的蓝色石蕊试纸先变红后变黑( )
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
下列有关元素锗及其化合物的叙述中正确的是
A.锗的第一电离能高于碳而电负性低于碳
B.四氯化锗与四氯化碳分子都是四面体构型
C.二氧化锗与二氧化碳都是非极性的气体化合物
D.锗和碳都存在具有原子晶体结构的单质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是( )
A.SO2使溴水褪色与乙烯使KMnO4溶液褪色的原理相同
B.制备乙酸乙酯时可用热的NaOH溶液收集产物以除去其中的乙酸
C.用饱和食盐水替代水跟电石反应,可以减缓乙炔的产生速率
D.用AgNO3溶液可以鉴别KCl和KI
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定体积的18 mol /L的浓硫酸中加入过量铜片并加热,被还原的硫酸为0.9 mol,则浓硫酸的实际体积 ( )
A.等于50mL B.大于50mL C.等于100mL D. 大于100Ml
查看答案和解析>>
科目:高中化学 来源: 题型:
将2.8 g Fe加入含9.45 g HNO3的稀溶液中,充分反应后测得Fe和HNO3都无剩余若HNO3被还原为NO,则Fe最终生成( )
A.Fe(NO3)3 B.Fe(NO3)2 C.Fe(NO3)3和Fe(NO3)2 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极分别电解下列各物质水溶液一段时间后,向剩余电解质溶液中加入适量水,能使溶液恢复到电解前浓度的是()
A. AgNO3 B. Na2SO4 C. CuCl2 D. H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实能用电化学理论解释的是()
A. 轮船水线以下的船壳上装一定数量的锌块
B. 铝片不用特殊方法保存
C. 纯锌与稀硫酸反应时,滴入少量浓H2SO4溶液后速率加快
D. 镀锌铁不如镀锡铁耐用
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写
一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序
号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+
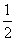 O2(g)
O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二
转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次
转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化
器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸
收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目
的。用化学方程式表示其反应原理。(只写出2个方程式即可)_____________
__________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:H2(g)+I2(g)⇌2HI(g);△H,在温度T1和T2时,产物的量与反应时间的关系如图所示.符合图示的正确判断是( )
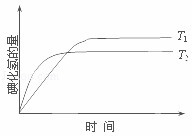
|
| A. | T1>T2,△H>0 | B. | T1>T2,△H<0 | C. | T1<T2,△H>0 | D. | T1<T2,△H<0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com