
 ��1mol I2��g�� ��2mol H2����2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g����H��0������ƽ�⣮HI���������w��HI����ʱ��仯��ͼ���ߣ�����ʾ��
��1mol I2��g�� ��2mol H2����2L�ܱ������У���һ���¶��·�����Ӧ��I2��g��+H2��g��?2HI��g����H��0������ƽ�⣮HI���������w��HI����ʱ��仯��ͼ���ߣ�����ʾ������ ��1����ƽ��ʱ��HI���������Ϊ60%������I2��g��+H2��g��?2HI��g����Ӧǰ��������䣬������n��HI��=3mol��60%=1.8mol���Դ˼���I2��g�������ʵ���Ũ�ȣ�
��2�����ߣ������ߣ��� Ϊ��ͬƽ��״̬�����¶���ͬ�����ߵ�ѹǿ��������ͬ�������ߣ��� ��Ӧ�Ͽ죻
��3���������¶Ȳ��䣬����һ����ͬ��2L�ܱ������м���2mol I2��g����4mol H2��g��������Ӧ���൱������ѹǿ��ƽ�ⲻ�ƶ���
��� �⣺��1����ƽ��ʱ��HI���������Ϊ60%������I2��g��+H2��g��?2HI��g����Ӧǰ��������䣬������n��HI��=3mol��60%=1.8mol���ɷ���ʽ��֪����0.9molI2��g�������ƽ��ʱ��I2��g�������ʵ���Ũ��Ϊ$\frac{1mol-0.9mol}{2L}$=0.05mol/L��
�ʴ�Ϊ��0.05��
��2�����ߣ������ߣ��� Ϊ��ͬƽ��״̬�������ߣ��� ��Ӧ�Ͽ죬ӦΪ�����������������������ߣ��� ӦΪ�����������Сѹǿ�����仯�¶ȣ�ƽ�ⷢ���ƶ��������ܴﵽ��ͬƽ��״̬��
�ʴ�Ϊ���ۢݣ��ܣ�
��3���������¶Ȳ��䣬����һ����ͬ��2L�ܱ������м���2mol I2��g����4mol H2��g��������Ӧ���൱������ѹǿ��ƽ�ⲻ�ƶ���HI�����������0.6���ʴ�Ϊ�����ڣ�
���� ���⿼����������Ի�ѧƽ���Ӱ�죬��Чƽ���֪ʶ�㣬Ϊ��Ƶ���㣬������ѧ���ķ��������ͼ��������Ŀ��飬ע���������ķ�Ӧ�ص㼰��Чƽ���Ӧ�ã�


 ��Կ���Ծ�ϵ�д�
��Կ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
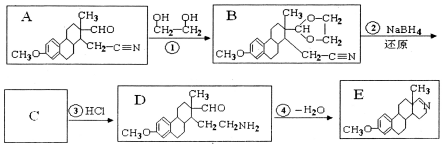
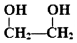 ������Ϊ�Ҷ�����д������Ա������ᷴӦ���ɸ߾���Ļ�ѧ����ʽ
������Ϊ�Ҷ�����д������Ա������ᷴӦ���ɸ߾���Ļ�ѧ����ʽ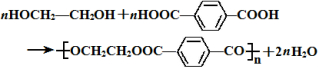 ��
��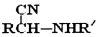 $\stackrel{H+}{��}$
$\stackrel{H+}{��}$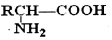
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| A | B | C | D | E | F | G | H | I | J | |
| ԭ�Ӱ뾶 ��10-10m�� | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| ������ ���ϼ� | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
 ��G��F�ֱ��γɵļ����Ӱ뾶��С��ϵΪN3-��Na+��
��G��F�ֱ��γɵļ����Ӱ뾶��С��ϵΪN3-��Na+�� ��
�� ��
�� ��
�� ���û�������ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪNaH+H2O=NaOH+H2������
���û�������ˮ��Ӧ�ų�����Ļ�ѧ����ʽΪNaH+H2O=NaOH+H2�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C5H12��l��+8O2��g���T5CO2��g��+6H2O��l����H=-3 540 kJ•mol-1 | |
| B�� | C5H12��l��+8O2��g���T5CO2��g��+6H2O��g����H=-3 540 kJ•mol-1 | |
| C�� | C5H12��l��+8O2��g���T5CO2��g��+6H2O��g����H=+3 540 kJ•mol-1 | |
| D�� | C5H12��l��+8O2��g���T5CO2��g��+6H2O��l����H=+3 540 kJ•mol-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ����Ϊ��ȩ���Ϸ�Ӧ��
����Ϊ��ȩ���Ϸ�Ӧ��
 ��
�� ��
�� ��
�� ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com