
分析 (1)实验I中Fe(OH)2Cl与盐酸反应生成氯化铁和水,过量的铁会和氯化铁反应生成氯化亚铁;
(2)10mL•mol/LFeCl2溶液(含HCl)滴入KSCN溶液无变化,加入过氧化氢溶液变红色,过氧化氢氧化亚铁离子为铁离子;
(3)10mL 0.1mol/LKI溶液,滴入6滴0.1mol/LFeCl3溶液得到黄色溶液,KI溶液过量,滴加KSCN溶液会使溶液变红色证明含铁离子,滴入淀粉溶液变蓝色,证明含有碘单质,同时含铁离子和碘离子说明反应为可逆反应;
(4)用6mL CCl4分三次洗涤后萃取碘单质,使得化学平衡正向进行,铁离子变化为亚铁离子,Fe3+用KSCN检验时最低显色浓度为1×10-5mol/L,据此分析;
解答 解:(1)实验I中Fe(OH)2Cl与盐酸反应生成氯化铁和水,过量的铁会和氯化铁反应生成氯化亚铁,反应的离子方程式为:Fe(OH)2Cl+2H+=Fe3++2H2O+Cl-,加入稍过量Fe粉的作用是将铁离子还原为亚铁离子,2Fe3++Fe=3Fe2+,防止Fe2+氧化变质,
故答案为:Fe(OH)2Cl+2H+=Fe3++2H2O+Cl-,将Fe3+还原为Fe2+,防止Fe2+氧化变质;
(2)10mL•mol/LFeCl2溶液(含HCl)滴入KSCN溶液无变化,加入过氧化氢溶液变红色,过氧化氢氧化亚铁离子为铁离子,铁离子结合硫氰酸根离子生成血红色溶液,反应的离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3,
故答案为:2Fe2++2H++H2O2=2Fe3++2H2O,Fe3++3SCN-=Fe(SCN)3;
(3)10mL 0.1mol/LKI溶液,滴入6滴0.1mol/LFeCl3溶液得到黄色溶液,KI溶液过量,滴加KSCN溶液会使溶液变红色证明含铁离子,滴入淀粉溶液变蓝色,证明含有碘单质,同时含铁离子和碘离子说明反应为可逆反应,推测黄色溶液中含有的溶质微粒有K+、Cl-和Fe3+、Fe2+、I2、I-,Fe3+与I-反应为可逆反应,反应的离子方程式为:2Fe3++2I-?2Fe2++I2,
故答案为:Fe3+、Fe2+、I2、I-,2Fe3++2I-?2Fe2++I2;
(4)某同学取2mL黄色溶液用6mL CCl4分三次洗涤后,再往水层中滴加KSCN溶液,发现溶液未变红.洗涤时是利用分液漏斗装置,所用的主要玻璃仪器是分液漏斗,
6mL CCl4分三次洗涤后萃取碘单质,2Fe3++2I-?2Fe2++I2,使得化学平衡正向进行,铁离子变化为亚铁离子,Fe3+用KSCN检验时最低显色浓度为1×10-5mol/L,当铁离子浓度低于此浓度无法显色,
故答案为:I2被萃取至CCl4中,平衡向生成亚铁离子的方向进行,多次萃取后铁离子浓度低于1×10-5mol/L,无法显色.
点评 本题考查了物质性质、离子检验、萃取分液的理解应用,实验现象的判断,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:实验题
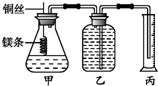 某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:
某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题.该小组设计的简易实验装置如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 燃烧产物为CO2和H2O的化合物一定是碳氢化合物 | |
| C. | 碳原子间以单键相连的烃是烷烃 | |
| D. | 烷烃分子的相对分子质量一定是偶数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔表示物质的质量的单位 | B. | 16gO2含有0.5mol O2分子 | ||
| C. | 2gH2的体积约为22.4L | D. | 物质的摩尔质量等于其式量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英玻璃、分子筛的主要成分是硅酸盐 | |
| B. | 分散系可分为溶液、浊液和胶体,浊液的分散质粒子大小介于溶液和胶体之间 | |
| C. | 铁在氧气中燃烧生成氧化铁,镁在空气中燃烧生成氧化镁、氮化镁 | |
| D. | 针对埃博拉病毒扩散情况,可选用含氯消毒剂对疫区可能的污染区域进行消毒预防 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
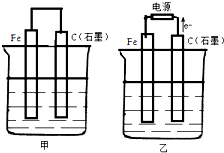 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
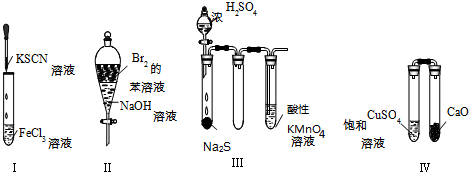
| A. | 实验Ⅰ:试管中溶液颜色变为红色 | |
| B. | 实验Ⅱ:振荡后静置,上层溶液颜色保持不变 | |
| C. | 实验Ⅲ:酸性KMnO4溶液中出现气泡,但颜色不会褪去 | |
| D. | 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com