
 ③Na2O2:
③Na2O2:

 ⑥N2电子式:
⑥N2电子式:
| A. | ①③⑤⑥ | B. | ①③④⑤ | C. | ①⑤⑥ | D. | ②⑤⑥ |
分析 ①氚原子中含有1个中子,质量数为3;
②硫离子的核电荷数为16,核外电子总数为18;
③过氧化钠为离子化合物,阴阳离子需要标出所带电荷,阴离子还需要标出最外层电子;
④该形成过程的左边缺少1个Cl原子的电子式;
⑤氨气为共价化合物,其分子中含有3个N-H键;
⑥氮气分子中含有1个氮氮三键,N原子最外层满足8电子稳定结构.
解答 解:①氚的质子数为1,该原子的质量数为3,可以表示为:${\;}_{1}^{3}$H,故①正确;
② 为S原子结构示意图,S2-的核外电子总数为18,正确的离子结构示意图为:
为S原子结构示意图,S2-的核外电子总数为18,正确的离子结构示意图为: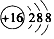 ,故②错误;
,故②错误;
③Na2O2为离子化合物,钠离子直接用离子符号表示,阴离子需要标出所带电荷及最外层电子,过氧化钠的电子式为 ,故③正确;
,故③正确;
④氯化钙为离子化合物,用电子式表示下列物质的形成过程为 ,故④错误;
,故④错误;
⑤氨气分子中为共价键,其分子中含有3个N-H键,NH3的结构式为 ,故⑤正确;
,故⑤正确;
⑥N2中含有氮氮三键,氮原子最外层达到8电子稳定结构,其电子式为 ,故⑥正确;
,故⑥正确;
故选A.
点评 本题考查常见化学用语的表示方法,题目难度不大,涉及电子式、结构式、元素符号、离子结构示意图等知识,明确常见化学用语的书写原则为解答关键,试题有利于提高学生的规范答题能力.


 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10mL3.4mol•L-1的FeCl3溶液滴入沸水中制成Fe(OH)3胶体,所得体系中胶粒的数目小于0.034NA | |
| B. | 3.6gH2O与19.6g浓硫酸所含分子数均为0.2NA | |
| C. | I7.4g MnO2与40mL 10mol•L-1浓盐酸反应,转移电于的数目为0.2NA | |
| D. | 常温下pH=4的醋酸溶液中由水电离出的H+的数目为10-10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、H2O、PH3的稳定性依次增强 | |
| B. | Li、Na、K、Rb、Cs的失电子能力逐渐减弱 | |
| C. | Al3+、Mg2+、Na+的离子半径依次减小 | |
| D. | NaOH、KOH、CsOH碱性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 托盘天平、烧杯、容量瓶、玻璃棒 | |
| B. | 烧杯、玻璃棒、胶头滴管、量筒 | |
| C. | 烧杯、容量瓶、玻璃棒、胶头滴管 | |
| D. | 烧杯、容量瓶、玻璃棒、胶头滴管、量筒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .D
.D .
. .
. 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率等于逆反应速率 | B. | 各物质的浓度不再改变 | ||
| C. | 反应停止了 | D. | 该反应达到最大限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Q1+Q2>Q3 | B. | Q1+Q2>2Q3 | C. | 2Q1+Q2<4Q3 | D. | 2Q1+Q2<2Q3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com