
【题目】硫是一种重要的非金属元素,在自然界中以游离态和多种化合态形式存在。其中二氧化硫是主要的大气污染物之一。完成下列填空:
(1)依据平衡移动原理,用化学用语解释将SO2通入CaCO3悬浊液使之变澄清的原因 。
(2)火法炼铜中有如下反应:
Ⅰ:2Cu2S(s)+3O2(g)=2Cu2O(s)+2SO2(g) ΔH =-768.2 kJ·mol—1
Ⅱ:2Cu2O(s)+ Cu2S(s)=6Cu(s)+SO2(g) ΔH = +116.0 kJ·mol—1
①在反应Ⅱ中,只作氧化剂的是 (用化学式表示)。
②反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的ΔH= 。
(3)工业上用过硫酸钾(K2S2O8)测定钢铁中的锰含量,配平下列反应式:
Mn2++ S2O82―+ H2O = MnO4―+ SO42―+ H+
(4)将SO2通入氯酸溶液中生成一种强酸和一种氧化物,已知反应掉1.5mol氯酸时转移了9.03×1023个电子,写出该反应的化学方程式 。
【答案】(1)CaCO3(s)![]() Ca2+(ag)+CO32—(ag) CO32—+2SO2+H2O=CO2+2HSO3—。
Ca2+(ag)+CO32—(ag) CO32—+2SO2+H2O=CO2+2HSO3—。
(2)①Cu2O② —217.4 kJ·mol—1(3)2、5、8, 2、10、16
(4)SO2+2HClO3=H2SO4+2ClO2
【解析】
试题分析:(1)亚硫酸的酸性强于碳酸,SO2能结合碳酸钙溶液中的碳酸根离子,沉淀溶解平衡向正反应方向进行,所以可以溶解碳酸钙,方程式为CaCO3(s)![]() Ca2+(ag)+CO32—(ag),CO32—+2SO2+H2O=CO2+2HSO3—;
Ca2+(ag)+CO32—(ag),CO32—+2SO2+H2O=CO2+2HSO3—;
(2)①在反应Ⅱ中Cu元素化合价从+1价降低到0价得到电子,S元素化合价从-2价升高到+4价,失去电子,所以只作氧化剂的是Cu2O。②根据盖斯定律可知(I+Ⅱ)÷3即得到反应Cu2S(s)+O2(g)=2Cu(s)+SO2(g)的ΔH=—217.4 kJ·mol—1。
(3)反应中Mn元素化合价从+2价升高到+7价,失去5个电子,S元素的化合价从+7价降低到+6 价,得到1个电子,根据电子得失守恒可知反应的方程式为2Mn2++5S2O82―+8H2O=2MnO4―+10SO42―+16H+。
(4)将SO2通入氯酸溶液中生成一种强酸和一种氧化物,强酸是硫酸,已知反应掉1.5mol氯酸时转移了9.03×1023个电子即1.5mol电子,所以1mol氯酸转移1mol电子,因此还原产物是二氧化氯,所以该反应的化学方程式为SO2+2HClO3=H2SO4+2ClO2。


科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入30mL浓度为10.00mol/L的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、NaClO3共存体系。下列判断正确的是( )
A.与NaOH反应的氯气一定为0.3 mol
B.n(Na+):n(Cl-)可能为7:3
C.若反应中转移的电子为n mol,则0.15<n<0.25
D.n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮(C3H6O)通常是无色液体,易溶于水,密度小于1 g·mL-1,沸点约为55℃。要从水与丙酮的混合物中将丙酮分离出来,下列方法中最为合理的是
A. 分液 B. 蒸馏 C. 过滤 D. 蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气在氯气中燃烧时发出苍白色火焰,在反应过程中,破坏1mol氢气中的化学键消耗的能量为a kJ,破坏1mol氯气中的化学键消耗的能量为b kJ,形成1mol HCl中的化学键释放的能量为c kJ,下列关系中正确的是( )
A.b>c
B.a+b>2c
C.a+b<c
D.a+b<2c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A.若2H2(g)+O2(g)=2H2O(g)ΔH=—483.6kJ·mol-1,则H2燃烧热为241.8kJ·mol-1
B.若C(石墨,s)=C(金刚石,s)ΔH>0,则石墨比金刚石稳定
C.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)ΔH=—57.4kJ·mol-1,则20.0gNaOH固体与稀盐酸完全中和,放出28.7kJ的热量
D.已知2C(s)+2O2(g)=2CO2(g)ΔH1;2C(s)+O2(g)=2CO(g)ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列两组热化学方程式中,有关ΔH的比较正确的是( )
①CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH1
CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH2
②NaOH(aq)+![]() H2SO4(浓)=
H2SO4(浓)=![]() Na2SO4(aq)+H2O(l) ΔH3
Na2SO4(aq)+H2O(l) ΔH3
NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l) ΔH4
A.ΔH1>ΔH2;ΔH3>ΔH4 B.ΔH1>ΔH2;ΔH3<ΔH4
C.ΔH1=ΔH2;ΔH3<ΔH4 D.ΔH1<ΔH2;ΔH3<ΔH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是生产氮肥、尿素等物质的重要原料。
(1)合成氨反应N2(g)+ 3H2(g)![]() 2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
2NH3(g)在一定条件下能自发进行的原因是 。电化学法是合成氨的一种新方法,其原理如图1所示,阴极的电极反应式是 。
(2)氨碳比[n(NH3)/n(CO2)]对合成尿素[2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
CO(NH2)2(g)+H2O(g)]有影响,恒温恒容时,将总物质的量3 mol的NH3和CO2以不同的氨碳比进行反应,结果如图2所示。a、b线分别表示CO2或NH3的转化率变化,c线表示平衡体系中尿素的体积分数变化。[n(NH3)/ n(CO2)]= 时,尿素产量最大;经计算,图中y= (精确到0.01)。
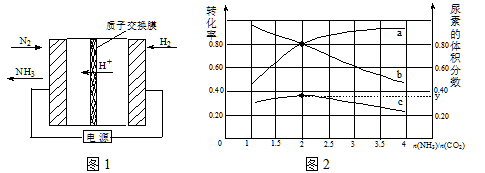
(3)废水中含氮化合物的处理方法有多种。
①用次氯酸钠氧化氨气,可以得到N2H4的稀溶液,该反应的化学方程式是_____________。
②用NaClO溶液也可将废水中的NH4+ 转化为N2。若处理过程中产生N2 0.672 L(标准状况),则需要消耗0.3 mol·L-1的NaClO溶液 L。
③在微生物的作用下,NH4+ 经过两步反应会转化为NO3-,两步反应的能量变化如图3所示。则1 mol NH4+ (aq)全部被氧化成NO3-(aq)时放出的热量是 kJ。
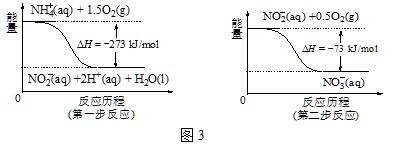
④用H2催化还原法可降低水中NO3-的浓度,得到的产物能参与大气循环,则反应后溶液的pH (填“升高”、“降低”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com