
【题目】与50 mL 0.1 mol·L-1的Na2CO3溶液中Na+的物质的量相同的溶液是( )
A.50 mL 0.2 mol·L-1的NaCl溶液B.100 mL 0.2 mol·L-1的NaCl溶液
C.25 mL 0.1 mol·L-1的Na2SO4溶液D.50 mL 0.1 mol·L-1的NaHCO3溶液
科目:高中化学 来源: 题型:
【题目】工业上利用如下反应制取P4:2Ca(PO4)2 +6SiO2+10C![]() 6CaSiO3+P4+10CO
6CaSiO3+P4+10CO
回答下列问题:
(1)基态硅原子的核外电子排布式为___。
(2)Si、P、S元素第一电离能大小关系为___。
(3)P4中P原子的杂化方式是___ ,P4的空间结构为___ ,键角∠PPP=___。
(4)与CO互为等电子的阴离子是___ (填化学式)。
(5)晶体硅与金刚石结构相似,下图为晶体硅的晶胞结构。已知硅原子的半径为r nm,晶体硅的密度是___g/cm3。
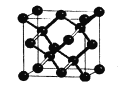
(6)硅的含氧化合物都以硅氧四面体(SiO4)作为基本结构单元,如图a所示,可简化为图b。

硅、氧原子通过共用氧原子形成各种不同的硅酸根负离子,如图c和图d,图c的化学式____________。在无限长链的硅酸根中硅氧原子之比为____。

硅、氧原子除可形成长链外,也可形成层状和立体网状结构。在立体网状结构中,硅、氧原子数之比为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把 NaOH、MgCl2、AlCl3 三种固体组成的混合物溶于足量水后,产生 1.16g 白色沉淀, 再向所得浊液中逐渐加入 2.00mol/LHCl 溶液,加入HCl 溶液的体积与生成沉淀的关系如图所示。
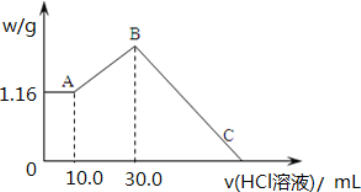
(1)A 点沉淀物的化学式为_____。B 点纵坐标为___________________。
(2)A 点至B 点改为通入二氧化碳气体,至少须标准状况下二氧化碳_____mL。此时发生反应的离子方程式为_____。
(3)B 点含溶质的物质的量是_____mol。C 点(此时沉淀恰好完全溶解)HCl 溶液的体积为_____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种实验某气体化学性质的实验装置,图中B为开关。如先打开B,在A处通入干燥的氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条褪色。则D瓶中盛有的溶液是( )

A. 浓硫酸B. 饱和氯化钠溶液C. 浓氢氧化钠溶液D. 氢氧化钙悬浊液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃,向20 mL 0.1 mol·L1 MOH溶液中滴加0.1 mol·L1 CH3COOH溶液, 所得溶液的pH(对应曲线M)及导电能力(对应曲线N)变化如图所示。下列叙述正确的是
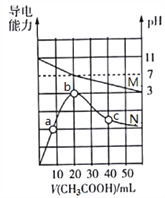
A. MOH是弱碱,其Kb=1.0×1021
B. b点溶液中,c(CH3COO)+ c(CH3COOH)=0.1 mol·L1
C. 水的离子积常数Kw:b>c>a
D. c点溶液中,c(CH3COO)>c(M+)>c(H+)>c(OH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯是一种非常重要的化工原料,利用苯可以合成多种有机物。有人设计了合成芳纶、PF树脂和肉桂酸乙酯的路线,如下图:
 回答下列问题:
回答下列问题:
(1)反应条件1是____________。
(2)B分子中的官能团的名称为_________,B→C的反应类型为____________。
(3)D的结构简式为________,生成PF树脂的化学方程式为_______________。
(4)试剂E是_________。
(5)由J合成肉桂酸乙酯的化学方程式为 _____________________。
(6)写出同时满足下列条件的肉桂酸乙酯的一种同分异构体__________。
①苯环上仅有2个取代基且处于对位
②能发生水解反应和银镜反应,其中一种水解产物遇FeCl3溶液显色
③存在顺反异构
(7)以D为原料,选用必要的无机试剂合成乙二醛,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上或下注明试剂和反应条件)。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】往 100 g FeCl3 和 CuCl2 的混合溶液中加入铁粉。已知 FeCl3会先与铁粉发生反应:2FeCl3 + Fe =3FeCl2。下图为加入铁粉的质量与反应后剩余固体质量关系。下列说法不正确的是

A.D 点对应纵坐标为 6.4
B.B 点后溶液的颜色为蓝色
C.该 100 g 溶液中的 CuCl2质量分数为 13.5%
D.取 DE 两点间(不含 D)的剩余固体加入盐酸,均有气泡产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于平衡状态的反应:2H2S(g)![]() 2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
2H2(g)+S2(g) ΔH>0,不改变其他条件的情况下,下列叙述正确的是( )
A.加入催化剂,反应途径将发生改变,ΔH也将随之改变
B.升高温度,正、逆反应速率都增大,H2S分解率也增大
C.增大压强,平衡向逆反应方向移动,将引起体系温度降低
D.若体系恒容,注入一些H2后达新平衡,H2的浓度将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几种物质:①盐酸;②Na2O;③Na2O2;④Al(OH)3;⑤Na2CO3;⑥H2O;⑦CO2;⑧乙醇;⑨Cu;⑩NaOH溶液。
(1)其中属于电解质的有___________(填写序号,下同),属于碱性氧化物的有_______。
(2)④与⑩反应的离子方程式为______________________________________。
(3)Na2O2因能发生下列反应被用作供氧剂:2Na2O2+2CO2=2Na2CO3+O2,该反应中,氧化剂与还原剂的物质的量之比为:______。
(4)如用超氧化钾(KO2)作供氧剂,写出它和CO2反应的化学方程式,并标出电子转移的方向和数目______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com