
海洋是一个丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用。
(1)海水中盐的开发利用:
①海水制盐目前以盐田法为主,建盐田必须选在远离江河入海口,多风少雨,潮汐落差大且又平坦空旷的海滩。所建盐田分为贮水池、 池和结晶池。
②工业上通常以NaCl 、CO2 和 NH3 为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:
(2)电渗析法是近年来发展起来的一种较好的海水淡化技术,其原理如图所示。其中具有选择性的阴离子交换膜和阳离子交换膜相间排列。请回答下面的问题:
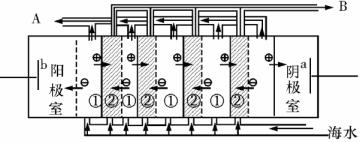
ⅰ电渗析法淡化海水中阴极室可获得的重要化工原料有
ⅱ上图中虚线部分表示 离子交换膜。 淡水从 (A或B) 排出。
(3)用苦卤(含Na+、K+、Mg2+、Cl-、Br-等离子)可提取溴,其生产流程如下:
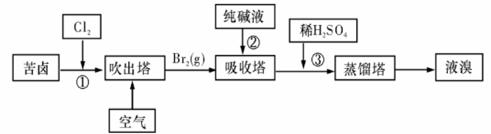
ⅰ写出反应③的离子方程式为: 。
ⅱ通过①氯化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液?
ⅲ向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是
。
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案科目:高中化学 来源: 题型:
向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如下表所示(溶液温度不变):则X物质可能为( )
| 微粒 | H+ | OH- | CH3COO- | CH3COOH |
| 物质的量浓度 | 减小 | 增大 | 增大 | 减小 |
A.氯化氢 B.氢氧化钠 C.蒸馏水 D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
下表各组物质中,物质之间不可能实现如图所示转化的是( )




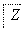
| 选项 | X | Y | Z | M |
| A | NH3 | NO | NO2 | O2 |
| B | Cl2 | FeCl3 | FeCl2 | Fe |
| C | Al | Al(OH)3 | NaAlO2 | NaOH |
| D | NaOH | Na2CO3 | NaHCO3 | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
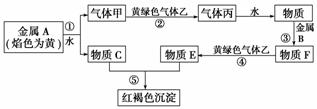
请根据以上信息回答下列问题:
(1)写出下列物质的化学式:A________、丙________。
(2)写出下列反应化学方程式:
反应①________________________________________________________________________;
反应⑤________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
以熔融Li2CO3和K2CO3为电解质,天然气经重整催化作用提供反应气的燃料电池如右图。下列说法正确的是
A.以此电池为电源电解精炼铜,当有0.1 mol e- 转移时,有3.2 g铜溶解
B.若以甲烷为燃料气时负极极反应式:
CH4+5O2--8e-=CO32-+2H2O
C.该电池使用过程中需补充Li2CO3和K2CO3
D.空气极发生的电极反应式为
O2+4e-+2CO2===2CO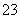
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B.室温下,1 L pH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
C.氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D.5NH4NO3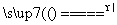 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将445 g焦硫酸溶于水配成4.00 L硫酸,该硫酸的物质的量浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于各图的叙述正确的是
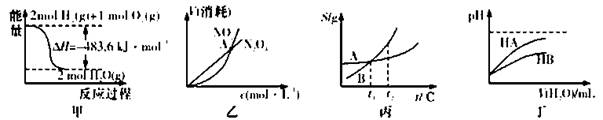
A.甲表示H2与O2发生反应过程中的能量变化,则H2的标准然烧热为△H=-241.8 kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2(g) N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将t1℃时A、B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则NaA溶液的pH小于同浓度的NaB浓液的pH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com