
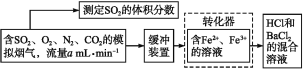
【题目】SO2是有用的化工原料,回收利用SO2既能减少大气污染,又能充分利用资源。有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成SO42-而实现SO2的回收利用。某研究性学习小组设计如下方案,在实验室条件下测定转化器的脱硫效率:
(1)写出Fe3+将SO2反应的离子方程式:__。
(2)若上述实验是在标准状况下进行的,欲测定转化器中的脱硫效率,现已测得气体流量和模拟烟气中SO2的体积分数,还需要测定的数据是___。
(3)向滴有紫色石蕊溶液的试管中通入SO2气体,现象是__;若再向其中滴入足量的氯水,现象是__,涉及反应的化学方程式为___。
【答案】2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ BaSO4沉淀的质量、时间 紫色石蕊溶液变红 滴加时,开始时溶液为红色,一段时间后,红色逐渐褪去 SO2+Cl2+2H2O=H2SO4+2HCl、Cl2+H2OHCl+HClO
【解析】
流程利用铁离子的强氧化性,使烟气中的二氧化硫转化为硫酸根离子,通过生成硫酸钡的量测定烟气中二氧化硫的含量。
(1)根据题给信息,SO2被Fe3+氧化成SO42-,则Fe3+被还原为Fe2+,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;
(2)已知气体的流量a mL·min-1,求气体的量,就必须要知道通入气体的时间,欲知道SO2的量,还要知道生成BaSO4沉淀的质量;
(3)SO2水溶液呈酸性,注意SO2虽有漂白性,但不能漂白石蕊溶液,现象为紫色石蕊溶液变红;向其中滴入氯水,氯水中的氯气与二氧化硫反应生成硫酸和盐酸,溶液呈酸性,溶液仍为红色,当消耗完二氧化硫后,氯水中的次氯酸氧化石蕊,使溶液红色逐渐褪去;涉及的反应为SO2+Cl2+2H2O=H2SO4+2HCl、Cl2+H2OHCl+HClO。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】强酸性溶液X中可能含有Na+、K+、NH4+、Fe2+、A13+、CO32-、SO32-、SO42-、C1-中的若干种,某同学为了确认其成分,取X溶液进行连续实验,实验过程及产物如下:

下列结论正确的是
A. X中肯定存在Na+、Fe2+、A13+、NH4+、SO42-
B. 气体F经催化氧化可直接生成气体D
C. 沉淀C一定是BaSO4、沉淀G一定是Fe(OH)3 、沉淀I一定是Al(OH )3
D. X中不能确定的离子是 A13+、Na+、K+和C1-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 mol/LNa2CO3溶液,下列操作正确的是
A. 称取10.6 g无水碳酸钠,加入100 mL容量瓶中,加水溶解、定容
B. 称取10.6 g无水碳酸钠,加入100 mL蒸馏水,搅拌、溶解
C. 转移Na2CO3溶液时,未用玻璃棒引流,直接倒入容量瓶中
D. 定容后,塞好瓶塞,反复倒转、摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近期,美国某研究小组在《Nature Energy》报道了一种 CO2 电解装置,膜界面处的离子通过中间通道重组直接制备高纯 HCOOH 溶液,其工作原理如图。下列说法正确的是
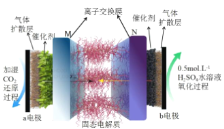
A.a 电极连接直流电源的正极
B.该电解池工作原理2CO2+2H2O![]() 2HCOOH+O2
2HCOOH+O2
C.M、N 分别是阴离子交换膜、阳离子交换膜
D.电路中转移 1mole- 时,阳极产生 5.6LO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用14.2 g无水硫酸钠配制成500 mL溶液,其物质的量浓度为___ mol·L-1。
(2)若从中取出50 mL,其物质的量浓度为___ mol·L-1;溶质的质量为___ g。
(3)若将这50 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为___ mol·L-1,SO42-的物质的量浓度为___ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
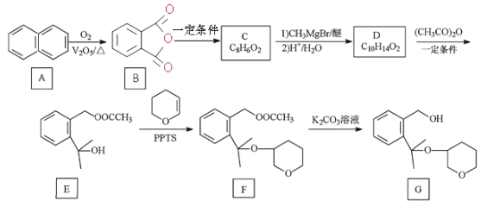
【题目】G 是合成抗新冠病毒药物的中间体,合成路线如图所示:
已知:R1COOR2![]()
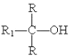 +R2-OH(R、R1、R2分别为烃基)
+R2-OH(R、R1、R2分别为烃基)
回答下列问题:
(1)G 中官能团的名称为____。
(2)C 的结构简式为____。
(3)写出 D 到 E 的方程式____,该反应类型为____。
(4)标 出 F  中的手性碳原子___。
中的手性碳原子___。
(5)H 与 G互为同分异构体,写出符合以下条件的一种结构简式____
①能发生水解反应;②核磁共振氢谱峰面积之比为 2:2:9:9
(6)已知RX![]() RMgX (X 表示卤素 原子) ,以苯甲醇 为原料制备
RMgX (X 表示卤素 原子) ,以苯甲醇 为原料制备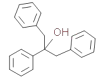 ,画出合成路线图___(无机试剂及有机溶剂任选)。
,画出合成路线图___(无机试剂及有机溶剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向a点(pH=a)的20.00mL 1.000molL-1氨水中滴入1.000molL-1盐酸,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法错误的是( )
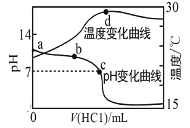
A.将此氨水稀释,溶液的导电能力减弱
B.b点溶液中离子浓度大小可能存在:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.c点时消耗盐酸体积V(HCl)<20.00mL
D.a、d两点的溶液,水的离子积Kw(a)>Kw(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,几种弱酸的电离常数如下:
弱酸的化学式 | CH3COOH | HCN | H2S |
电离常数(25 ℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7 K2=7.1×10-15 |
25 ℃时,下列说法正确的是
A.等物质的量浓度的各溶液的pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN)
B.a mol/L HCN溶液与b mol/L NaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定大于b
C.NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-)
D.某浓度的HCN溶液的pH=d,则其中c(OH-)=10-d mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某晶体 M·nH2O溶于水后,溶液温度降低。而 M(s)溶于水后,溶液温度升高,可将变化过程表示为图。下列说法中错误的是( )
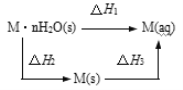
A.△H1=△H2+△H3
B.M(s)溶于水形成溶液△S>0
C.△H2>△H3
D.△H1+△H3>△H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com