
【题目】下列物质中,能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN﹣;②Fe;③Fe2+;④Cu;⑤Zn;⑥OH﹣ .
A.①②③
B.②④⑤
C.①③⑥
D.①②⑤
科目:高中化学 来源: 题型:
【题目】我国预计在2020年前后建成自己的载人空间站。为了实现空间站的零排放,循环利用人体呼出的CO2并提供O2,我国科学家设计了一种装置(如下图),实现了“太阳能一电能一化学能”转化,总反应方程式为2CO2=2CO+O2 。关于该装置的下列说法不正确的是

装置a 装置b
附:⊕表示阳离子,Θ表示阴离子
A. 装置a将太阳能转化为电能,装置b将电能转化为化学能
B. 工作过程中OH-向Y电极周围移动
C. 人体呼出的气体参与X电极的反应:CO2+2e-+H2O=CO+2OH-
D. 反应完毕后恢复到原温度,装置b中电解质溶液的碱性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列五种溶液:
① 0.1mol/L NH4Cl
② 0.1mol/L CH3COONH4
③ 0.1mol/L NH4HSO4
④ 0.1mol/L NH3·H2O和0.1mol/L NH4Cl的混合液
请根据要求填写下列空白:
(1)溶液①呈酸性,其原因是__________________________________(用离子方程式表示)
(2)比较溶液②、③中c(NH4+)的大小关系是②____③(填“>”“=”或“<”)。
(3)在溶液④中,_________离子的浓度为0.1mol/L;NH3·H2O和 ___________离子的浓度之和为0.2 mol/L。
(4)室温下,测得溶液②的pH=7, CH3COO-与NH4+浓度的大小关系是:c(CH3COO-)______c(NH4+)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个不同密闭容器中按不同方式投料,一定条件下发生反应(起始温度和起始体积相同):A2(g)+3B2(g)![]() 2AB3(g) ΔH<0,相关数据如下表所示:
2AB3(g) ΔH<0,相关数据如下表所示:
容器 | 甲 | 乙 | 丙 |
相关条件 | 恒温恒容 | 绝热恒容 | 恒温恒压 |
反应物投料 | 1mol A2、3molB2 | 2molAB3 | 2mol AB3 |
反应物的转化率 | a甲 | a乙 | a丙 |
反应的平衡常数K= | K甲 | K乙 | K丙 |
平衡时AB3的浓度/mol·L-1 | c甲 | c乙 | c丙 |
平衡时AB3的反应速率/mol·L-1·min-1 | V甲 | v乙 | v丙 |
下列说法正确的是( )
A. K乙<K丙 B. c乙=c丙 C. a甲 +a乙<1 D. v甲=v丙
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以某铬矿石(主要成分是Cr2O3,含FeO、SiO2等杂质)为原料生产Cr2O3的流程如下:
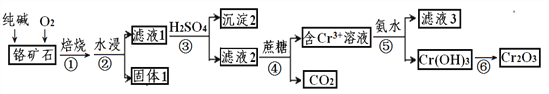
已知:Cr2O72-+H2O![]() 2CrO42-+2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
2CrO42-+2H+,Ksp[Cr(OH)3] =6.4×10-31,lg2 = 0.3
(1)步骤①中为了提高反应速率应该采取的措施有____、_____。(写2种)
(2)焙烧时Cr2O3被氧化成Na2CrO4,配平下面的化学方程式,并用单线桥表示电子转移的方向和数目:
Na2CO3+ Cr2O3+ O2![]() Na2CrO4 + CO2,______________
Na2CrO4 + CO2,______________
(3)流程中沉淀2为_________(填化学式)
(4)步骤④发生的反应中Cr2O72-和蔗糖(C12H22O11)的物质的量之比为_____。
(5)步骤⑤中为了使Cr3+完全沉淀[此时,c(Cr3+)≤10-5mol·L-1],pH至少调至____。
(6)滤液3中的主要溶质是两种盐,化学式为_________、________。
(7)另一种制取Cr(OH)3的工艺是将NaCrO2溶解后通入CO2得到更为纯净的Cr(OH)3,则NaCrO2溶液与过量CO2反应的离子方程式为_____________________。。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。
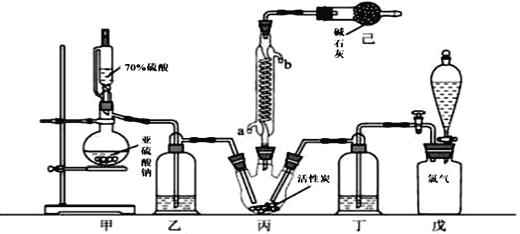
已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置甲中作为反应容器的仪器的名称为________,装置己的作用是________;如何控制两种反应物体积相等:________。
(2)装置戊上方分液漏斗中最好选用下列试剂:(_______)(选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是________________________________________。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H =SO2Cl2 + H2SO4,分离两种产物的方法是(_______) (选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是________ (用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为________。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有________________ ________________________________________ (写两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下1molC3H8发生如下反应:①C3H8→C2H4+CH4②C3H8→C3H6+H2如果C3H8的转化率为80%,且混合气体中m(CH4)=m(H2),则下列说法正确的是( )
A. 反应后混合气体的平均相对分子质量为35.2
B. 两种烯烃物质的量之比,即n(C2H4)/n(C3H6)为1∶1
C. 将混合气体通入溴的四氯化碳溶液,溶液增重128g
D. 两种烯烃物质的量之和,即n(C2H4)+n(C3H6)为0.8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com