
醋酸和氢氧化钠溶液发生反应的离子方程式正确的是
A.H++OH-→H2O B.H++ NaOH→Na++H2O
C.CH3COOH +OH-→CH3COO- +H2O D.CH3COOH + NaOH→CH3COO-+ Na++H2O
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:
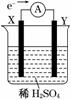 如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )
A.外电路的电流方向为:X→外电路→Y
B.若两电极分别为铁和碳棒,则X为碳棒,Y为铁
C.X极上发生的是氧化反应,Y极上发生的是还原反应
D.若两电极都是金属,则它们的活动性顺序为X>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室用浓度为0.500mol/L的标准氢氧化钠溶液来测定未知浓度的盐酸,完善下列实验过程:
(1)滴定管使用前,先要检查滴定管的活塞 ,活塞旋转是否灵活。
(2)把标准氢氧化钠溶液注入用标准氢氧化钠溶液润洗过的蓝色手柄滴定管中,使液面位于 位置,记录读数。
(3)在锥形瓶中放入20.00mL的待测溶液,再滴加2滴酚酞,摇匀。用标准氢氧化钠溶液滴定,边滴边摇动锥形瓶,眼睛注视 的变化。直到滴入最后一滴氢氧化钠溶液,指示剂的颜色由 色变为 色,并在半分钟内溶液颜色不发生变化,停止滴定,记录读数。
(4)重复(2)和(3)操作,并记录数据。再次滴定消耗氢氧化钠溶液的数据如下表:
| 次数 | 滴定前(mL) | 滴定后(mL) |
| 1 | 0.40 | 21.10 |
| 2 | 0.10 |
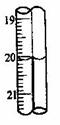 第2次滴定后滴定管的读数如右图所示,将这一读数填入上表中。根据表中的数据计算出盐酸的浓度为 mol/L。
第2次滴定后滴定管的读数如右图所示,将这一读数填入上表中。根据表中的数据计算出盐酸的浓度为 mol/L。
已知盐酸的准确浓度为0.490mol/L,则实验误差为 %。
(5)会造成实验结果偏高的操作是 (填写编号)。
a. 锥形瓶用蒸馏水洗净后,立即装入待测溶液
b. 振荡时溶液溅出锥形瓶外
c. 滴定时蓝色手柄滴定管中的液体滴在锥形瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项操作中,“不发生先产生沉淀,然后沉淀又溶解”现象的是
①向饱和碳酸钠溶液中通入过量的CO2;②向NaAlO2溶液中逐滴加入过量的稀盐酸;③向AlCl3溶液中逐滴加入过量稀氢氧化钠溶液;④向硅酸钠溶液中逐滴加入过量的盐酸
A.①②  B.①③
B.①③
C.①④ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
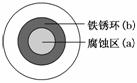 将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
将 NaCl 溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆圈中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘处少。下列说法正确的是( )
A.液滴中的 Cl-由 a 区向 b 区迁移
B.液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-===4OH-
C.液滴下的 Fe 因发生还原反应而被腐蚀,生成的 Fe2+由 a 区向 b 区迁移,与 b 区的OH-形成 Fe(OH)2,进一步氧化、脱水形成铁锈
D.若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加 NaCl 溶液,则负极发生的电极反应为:Cu-2e-===Cu2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com