
【题目】狄尔斯和阿尔德在研究1,3-丁二烯的性质时发现如下反应:
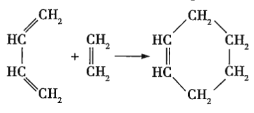 (也可表示为:
(也可表示为:![]() )
)
回答下列问题:
(1)狄尔斯-阿尔德反应属于______(填反应类型)。
(2)下列不能发生狄尔斯-阿尔德反应的有机物是________(填序号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(3)工业上通常以甲醛、乙炔为原料制取1,3-丁二烯,生产流程如下:
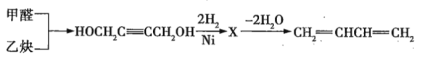
①X的结构简式为_________________;
②X转化成1,3-丁二烯的化学方程式为_______________________。
(4)三元乙丙橡胶的一种单体M的键线式为![]() ,它的分子式为________。下列有关它的说法不正确的是_____________________(填序号)。
,它的分子式为________。下列有关它的说法不正确的是_____________________(填序号)。
A.在催化剂作用下,![]() 最多可以消耗
最多可以消耗![]() B.能使酸性
B.能使酸性![]() 溶液褪色
溶液褪色
C.不能使溴的![]() 溶液褪色 D.分子中含有2个手性碳原子
溶液褪色 D.分子中含有2个手性碳原子
【答案】加成反应 c ![]()
![]()
![]() C
C
【解析】
(3)碳碳三键和氢气发生加成反应,![]() 碳碳三键可与
碳碳三键可与![]() 氢气发生加成反应,即X的结构简式为
氢气发生加成反应,即X的结构简式为![]() ,1molX在浓硫酸和加热的条件下消去
,1molX在浓硫酸和加热的条件下消去![]() 。
。
(1)此反应的特点是两种物质生成一种物质,为加成反应,故答案为:加成反应;
(2)具有1,3-丁二烯结构的有机物能发生狄尔斯-阿尔德反应,所以abd均能发生狄尔斯-阿尔德反应,c不能,故答案为:c;
(3)①碳碳三键和氢气发生加成反应,![]() 碳碳三键可与
碳碳三键可与![]() 氢气发生加成反应,即X的结构简式为
氢气发生加成反应,即X的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
②1mol![]() 在浓硫酸和加热条件下发生消去反应生成
在浓硫酸和加热条件下发生消去反应生成![]() ,方程式为:
,方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)由结构可知,有机物M的分子式为![]() 。
。
A.![]() 中含有
中含有![]() 碳碳双键,
碳碳双键,![]() 碳碳双键最多消耗
碳碳双键最多消耗![]() ,即
,即![]() 最多消耗
最多消耗![]() ,A正确;
,A正确;
B.M中含有碳碳双键,因此能使酸性高锰酸钾溶液褪色,B正确;
C.M中含有碳碳双键,能使溴的![]() 溶液褪色,C错误;
溶液褪色,C错误;
D.M分子中有2个手性碳原子,如图“*”所示: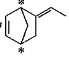 ,D正确。
,D正确。
故答案为:![]() ;C。
;C。


科目:高中化学 来源: 题型:
【题目】如图是某无机化合物的二聚分子结构示意图,该分子中A、B两种元素都是第3周期的元素,分子中所有原子的最外层都达到8个电子的稳定结构。下列说法不正确的是( )
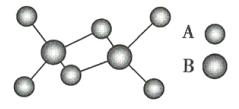
A.该物质的化学式是Al2Cl6B.该物质是离子化合物,在熔融状态下能导电
C.该物质在固态时所形成的晶体是分子晶体D.该物质中不存在离子键,也不含有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯分子中不存在碳碳单键和碳碳双键的交替结构,下列可以证明该结论的事实是( )
①苯不能使酸性![]() 溶液褪色 ②苯分子中碳碳键的键长完全相等 ③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷 ④经实验测得对二甲苯只有一种结构 ⑤苯在溴化铁作催化剂条件下与液溴可发生取代反应,但不能因发生化学反应而使溴水褪色
溶液褪色 ②苯分子中碳碳键的键长完全相等 ③苯能在加热和催化剂存在的条件下与氢气发生反应生成环己烷 ④经实验测得对二甲苯只有一种结构 ⑤苯在溴化铁作催化剂条件下与液溴可发生取代反应,但不能因发生化学反应而使溴水褪色
A.②③④B.②④⑥C.①②⑤D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用乙醇制备溴乙烷:CH3CH2OH+HBr![]() CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
CH3CH2Br+H2O,但通常采用溴化钠和浓硫酸与乙醇共热的方法。下面是某同学对该实验的猜想,你认为可能错误的是( )
A.制备过程中可能看到有气泡产生
B.可以将适量的NaBr、H2SO4(浓![]() 、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
、CH3CH2OH三种药品置入一种容器中加热制备CH3CH2Br
C.如在夏天做制备CH3CH2Br的实验,实际收集到的产物可能较少
D.为了除去CH3CH2Br中混有的HBr,可用热的NaOH溶液洗涤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镓(GaN)是第三代半导体材料,具有热导率高、化学稳定性好等性质,在光电领域和高频微波器件应用等方面有广阔的前景。
(1)传统的氮化镓制各方法是采用GaC13与NH3在一定条件下反应。NH3的电子式为___。
(2)Johnson等人首次在1100℃下用液态镓与氨气制得氮化镓固体,该可逆反应每生成1 mol H2放出10.3 kJ热量。其热化学方程式为_________。
(3)在恒容密闭容器中,加入一定量的液态镓与氨气发生上述反应,测得反应平衡体系中NH3的体积分数与压强(p)、温度(T)的关系如图所示。
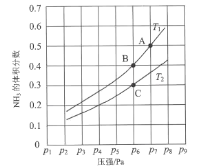
①下列说法正确的是___(填标号)。
a. 温度:T1>T2
b. 当百分含量ω(NH3)=ω(H2)时,说明该反应处于化学平衡状态
c. A点的反应速率小于C点的反应速率
d. 温度恒定为T2,达平衡后再充入氦气(氦气不参与反应),NH3的转化率不变
②既能提高反应速率又能使平衡正向移动的措施有___(写出一条即可)。
③气体分压(p分)=气体总压(p总)×体积分数,用平衡分压代替物质的量浓度也可以表示平衡常数(记作Kp)。在T2时,用含p6的计算式表示C点的______。
(4)如图可表示氮化镓与铜组装成的人工光合系统的工作原理。H+向______(填“左”或“右”)池移动;铜电极上发生反应的电极反应式为_______。
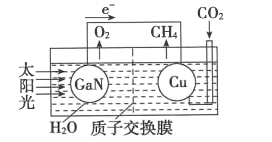
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】洛匹那韦(Lopinavir)是抗艾滋病毒常用药,在“众志成城战疫情”中,洛匹那韦,利托那韦合剂被用于抗新型冠状病毒(2019-nCoV)。洛匹那韦的合成路线可设计如图:

回答下列问题:
(1)A的化学名称是_______;A制备B反应的化学方程式为_________(注明反应条件)。
(2)D生成E的反应类型为_____;F中能与氢气发生加成反应的官能团名称为___。
(3)C的分子式为_____;一定条件下,C能发生缩聚反应,化学方程式为_____。
(4)K2CO3具有碱性,其在制备D的反应中可能的作用是______。
(5)X是C的同分异构体,写出一种符合下列条件的X的结构简式______。
①含有苯环,且苯环上的取代基数目≤2
②含有硝基
③有四种不同化学环境的氢,个数比为6:2:2:1
(6)已知:CH3COOH![]() CH3COCl,(2,6-二甲基苯氧基)乙酰氯(
CH3COCl,(2,6-二甲基苯氧基)乙酰氯(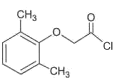 )是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
)是由G合成洛匹那韦的原料之一,写出以2,6-二甲基苯酚、ClCH2COOCH2CH3、K2CO3为原料制各该物质的合成路线________(其它无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氨基酸中含C、N、H、O四种元素,已知除氢原子外,其他原子均达到最外层8电子的稳定结构。如图为该氨基酸分子的球棍模型:
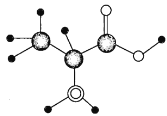
(1)氨基酸是_________(填“淀粉”“纤维素”“蛋白质”或“油脂”)完全水解的产物,该氨基酸的结构简式为__________。
(2)该氨基酸中含氧官能团的名称是____________。
(3)在浓硫酸、加热的条件下,该氨基酸与乙醇发生酯化反应的化学方程式为______。
(4)互为同系物的有机物具有相同的官能团,与该氨基酸互为同系物且少一个碳原子的氨基酸的结构简式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA,下列说法正确的是
A.25°C时,pH=13的氢氧化钡溶液中含有OH-0.1NA个
B.电解精炼铜时,当电路中转移NA个电子,阳极的质量一定减轻了32g
C.0.1 mol H2和0.1 mol I2于密闭容器中充分反应后,其分子总数为0.2NA
D.1 L 0.1 mol·L-1 NH4Cl溶液中,NH4+的数量为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为原子序数依次增大的前四周期元素,元素W是宇宙中最丰富的元素,元素X的原子的最外层电子数是其内层电子数的3倍,元素Z的基态原子核外电子有24种运动状态,Y、X、Z不在同一周期,且元素Y的基态原子核外p电子比s电子多5个。
(1)Z的基态原子的核外电子排布式为____________________。
(2)Z的氧化物是石油化工中重要的催化剂之一,可催化异丙苯裂化生成苯和丙烯
①1 mol丙烯分子中含有![]() 键与
键与![]() 键数目之比为__________________。
键数目之比为__________________。
②苯分子中碳原子的杂化类型为_________________。
③Z的一种氧化物ZO5中,Z的化合价为+6,则其中过氧键的数目为______________。
(3)W、X、Y三种元素的电负性由小到大的顺序为_________________(用元素符号表示)。
(4)ZY3的熔点为1152℃,其在熔融状态下能够导电,据此可判断ZY3晶体属于____________(填晶体类型)。
(5)ZX2晶体的晶胞结构如图所示。若该化合物的相对分子质量为M,晶胞边长为a pm,阿伏加德罗常数的值为NA,则该晶体的密度为_________ g/cm3。
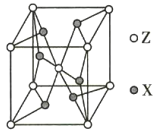
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com