
| A. | 增大压强,单位体积内活化分子数目不变,化学反应速率增大 | |
| B. | 升高温度,活化分子数目增大,化学反应速率增大 | |
| C. | 加入反应物,单位体积内活化分子数目增大,化学反应速率增大 | |
| D. | 使用催化剂,单位体积内活化分子数目增大,化学反应速率增大 |
科目:高中化学 来源: 题型:选择题
| A. | 稀豆浆、淀粉溶液、CuSO4溶液均为胶体 | |
| B. | 溶液和胶体的本质区别在于是否能产生丁达尔效应 | |
| C. | NaCl 溶液和BaSO4悬浊液的本质区别是分散质粒子的大小 | |
| D. | 直接加热饱和氯化铁溶液就可以制得氢氧化铁胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O | B. | Na2O2 | C. | Na2O和Na2O2 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 常温下,该试剂可与金属铝反应生成大量的无色气体 | |
| B. | 1mol Zn与足量的该硫酸反应生成2g氢气 | |
| C. | 该硫酸与等体积水混合所得溶液的物质的量浓度大于9.2mol/L | |
| D. | 向50mL该硫酸中加入足量的铜片,加热,反应后被还原的硫酸的物质的量等于0.46mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)中国古代四大发明之一--黑火药,它的爆炸反应为S+3C+2KNO3$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑.
(1)中国古代四大发明之一--黑火药,它的爆炸反应为S+3C+2KNO3$\frac{\underline{\;点燃\;}}{\;}$K2S+3CO2↑+N2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
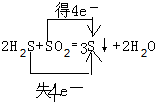 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com