
可逆反应2NO2 2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
2NO+O2在体积不变的密闭容器中反应,达到平衡状态的标志是
①单位时间内生成n molO2的同时生成2n mol NO2
②用NO2、NO、O2的物质的量浓度变化表示的反应速率的比为2:2:1的状态
③混合气体的颜色不再改变的状态
④混合气体的密度不再改变的状态
⑤混合气体的平均相对分子质量不再改变的状态
A.①③⑤ B.②③⑤ C.①③④ D.①②③④⑤
 全能测控一本好卷系列答案
全能测控一本好卷系列答案 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源:2013-2014学年北京市丰台区高三下学期统一练习(一)化学试卷(解析版) 题型:选择题
化学与生活密切相关,下列说法正确的是
A.食盐可作调味剂 B.CO2属于大气污染物
C.柠檬很酸,属于酸性食物 D.用聚氯乙烯塑料袋包装食品
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
某浓H2SO4的标签上写明含H2SO4 96~98.3%,欲得其准确的值,有效的方法是
A.测pH值 B.测导电性大小 C.测密度 D.进行中和滴定
查看答案和解析>>
科目:高中化学 来源:2013-2014学年上海市徐汇、松江、金山三区高三二模化学试卷(解析版) 题型:选择题
将CO2转化成有机物可有效实现碳循环。下列反应中,最节能的是
A.CO2 + 3H2 CH3OH +H2O
CH3OH +H2O
B.6CO2 + 6H2O C6H12O6 + 6O2
C6H12O6 + 6O2
C.CO2 + CH4 CH3COOH
CH3COOH
D.2CO2 + 6H2 CH2=CH2 + 4H2O
CH2=CH2 + 4H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
由乙炔(C2H2)、苯和甲醛(CH2O)组成的混和物中,测得含碳元素的质量百分含量为72%,则混和物中氧元素的质量百分含量为
A.20.7% B.22% C.24.9% D.28%
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
能与Na反应放出H2,又能使溴水褪色,但不能使pH试纸变色的物质是
A.CH2=CH—COOH B.CH2=CH—CH2OH
C.CH2=CH—CH3 D.CH2=CH—COOCH3
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市高一下学期期中考试化学试卷(解析版) 题型:选择题
元素在周期表中的位置,反映了元素的原子结构和元素的性质,下列说法正确的是
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河西区高三总复习质量检测二理综化学试卷(解析版) 题型:填空题
(18分)铁及其他合物在工业生产中有着广泛的应用。请按要求回答下列问题:
I.工业上利用硫酸铁矿烧渣(主要成分为Fe2O3、Al2O3、SiO2等)为原料提取Fe2O3,工艺流程如下图1:
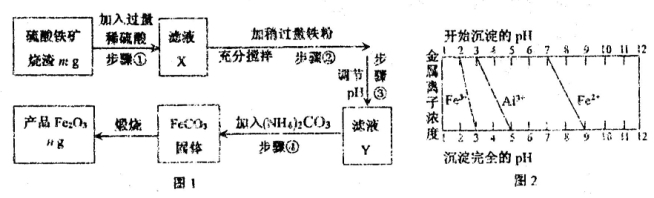
(1)滤液X中所含金属阳离子有 。
(2)步骤②中理论上发生反应的离子方程式依次为 。
(3)结合图2,分析步骤③调节pH的目的是 。
(4)假设流程中矿渣中的铁元素100%转化到产品中,则硫酸铁矿烧渣样品中Fe2O3的质量分数范围为(含m、n的代数式) 。
(5)请设计实验室中以硫酸铁矿烧渣为原料提取氧化铁的另一种方案:向硫酸铁矿烧渣原料中加入过量稀硫酸、充分搅拌、过滤,再向滤液中加入足量的 溶液,接下来的一系列操作是搅拌、 、洗涤、 ,最后获得纯净的产品Fe2O3。
Ⅱ.几位同学用铁盐溶液清洗试管中银镜,实验设想如下:
(6)甲:认为含Fe3+的盐无法洗去银镜。依据是Fe3+的氧化性(填“强于”或“弱于”) Ag+的氧化性,所以反应Fe3++Ag→Fe2++Ag+不可以发生。
(7)乙:查资料发现,用FeCl3溶液可以清洗银镜,于是他亲自动手实验,发现银镜迅速消失,另外还观察到溶液变为浅绿色;为验证Fe3+的还原产物,可选择的试剂为 。结合甲的分析和自己的实验现象他得出结论:反应Fe2++Ag→Fe3++Ag是(填“可逆”或“不可逆”) 反应。
(8)丙:结合甲、乙的设想,他用Fe(NO3)3溶液做对比实验,发现清洗银镜的速率慢许多,他重新观察乙的实验试管中有白色沉淀,于是结合化学平衡理论分析,得出用FeCl3溶液清洗银镜的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市河东区高三一模理综化学试卷(解析版) 题型:计算题
(18分)Heck反应是合成C--C键的有效方法之一,如反应

化合物II可由以F合成路线获得:
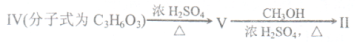
(1) Heck反应的反应类型是____反应;V→II的反应类型是_________反应
(2)化合物III的分子式为___________,1 mol化合物III最多可与_______mol H2发生加成反应。
(3)若化合物IV分子结构中有甲基,写出由化合物IV反应生成化合物V的化学方程式 ________________________________________________________.
(4)有关化合物II说法正确的是________________
A.l mol化合物II完全燃烧消耗5 mol O2
B.化合物II能使酸性高锰酸钾溶液褪色
C.化合物II难溶于水
D.化合物II分子间聚合,反应生成的高聚物结构为
(5)化合物III的一种同分异构体VI,苯环上的一氯取代物有两种,VI能与NaHCO3溶液反应生成无色气体,除苯环上的氢外核磁共振氢谱还有四组峰,峰面积之比为1:1:1:3,VI的结构简式为_______________________________.
(6) 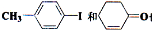 也可以发生类似反应①的反应,反应后有机产物的
也可以发生类似反应①的反应,反应后有机产物的
结构简式为_________________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com