
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为________。
(2)上述反应中的氧化剂是________,反应产生的气体可用________吸收。
(3)As2S3和HNO3有如下反应:
As2S3+10H++10NO3-===2H3AsO4+3S+10NO2↑+2H2O若生成2 mol H3 AsO4,则反应中转移电子的物质的量为________。若将该反应设计成一原电池,则NO2应该在________(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2和11.2 L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量________(选填编号)。
a.小于0.5 mol b.等于0.5 mol
c.大于0.5 mol d.无法确定
解析 (1)As在As2S3中的化合价为+3,在As4S4中的化合价为+2,每摩As2S3转化为As4S4时得到2 mol e-,而每摩SnCl2转化为SnCl4时失去2 mol e-,故二者在反应时物质的量之比为1∶1。(2)H2S既可与NaOH溶液反应,又能与CuSO4溶液反应。(3)当生成2 mol H3AsO4时,同时生成了3 mol S,二者共失去电子10 mol。HNO3在反应中作氧化剂,在正极上发生反应,所以NO2应在正极上生成。(4)根据反应4NO2+O2+2H2O===4HNO3可知,反应共生成2 mol HNO3,浓HNO3与碳反应时的物质的量之比为4∶1,所以2 mol HNO3如完全反应可生成CO2 0.5 mol。但由于硝酸的浓度降低到一定程度时,碳就不再与硝酸反应,所以实际产生CO2的物质的量应小于0.5 mol。
答案 (1)1∶1 (2)As2S3 氢氧化钠溶液(或硫酸铜溶液) (3)10 mol 正极 (4)a


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
利用下列实验装置进行的相应实验,能达到实验目的的是
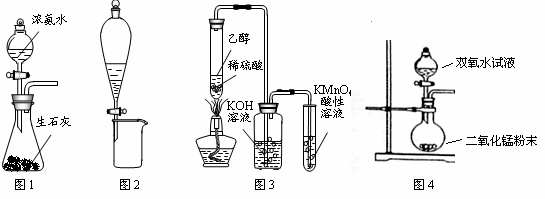
A.图1所示装置可制备氨气
B.图2所示装置可分离CH3CH2OH和CH3COOC2H5的混合液
C.图3所示装置可制备、收集乙烯并验证其易被氧化
D.图4所示装置可制备氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学反应与能量的说法正确的是( )
A.化学反应中一定有物质变化,但不一定有能量变化
B.CaO+H2O =Ca(OH)2是放热反应,说明CaO 的能量大于Ca(OH)2的能量
C.Ba(OH)2·8H2O晶体与氯化铵晶体反应不需加热就能发生,说明该反应是放热反应
D.由H2→2H的过程需要吸收能量
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E、F、G七种元素,试按下列所给条件推断,
①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期
中最大,且原子半径A>B>C
②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质
是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气态
④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族,C的原子结构示意
图是
(2)A元素与D元素形成化合物的电子式是
(3)F的元素符号是
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式
是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学
式是
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方
程式是
查看答案和解析>>
科目:高中化学 来源: 题型:
根据表中信息判断,下列选项不正确的是 ( )。
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4…… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-…… | Cl2、Mn2+…… |
A. 第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱的顺序为MnO4->Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
英国物理学家约翰·丁达尔首先发现了入射光透过胶体时,从侧面可以看到一条光亮的通路。下列液体中,不会出现丁达尔效应的分散系的是 ( )。
①鸡蛋白溶液 ②水 ③淀粉溶液 ④硫酸钠溶液 ⑤沸水中滴入饱和FeCl3溶液 ⑥肥皂水
A.② B.①③ C.⑤⑥ D.④
查看答案和解析>>
科目:高中化学 来源: 题型:
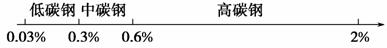
用数轴表示化学知识,并按某种共性对化学物质进行分类,有简明易记的效果。例如,根据碳素钢的含碳量,将其分为低碳钢、中碳钢、高碳钢,利用数轴分类法可将其表示为:
根据这一分类方法请回答:
(1)25 ℃将pH与溶液酸碱性的关系粗略地表示在如下数轴上:
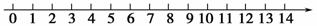
(2)某化学兴趣小组欲研究H2SO4、KCl、NaCl、Na2CO3、Na2SO3、NaOH六种物质的性质,对于如何研究,他们设计了两种研究方案:
方案Ⅰ:将它们按照酸、碱、盐分类,然后分别溶于水得到溶液,进行实验。
方法Ⅱ:将它们按照钠盐、钾盐和其他化合物分类,然后分别溶于水得到溶液,进行实验。
①根据方案Ⅰ进行分类时,经实验测得KCl、NaCl溶液的pH等于7;H2SO4溶液的pH小于7;Na2SO3、Na2CO3、NaOH溶液的pH大于7。由此有的同学按分类法思想把Na2SO3、Na2CO3与NaOH都划分为碱类是否合理?为什么?____________________________________________________________。
②在方案Ⅰ中,某同学发现盐类物质中的KCl、NaCl在与其他物质混合时现象相同,无法区分,请设计一种简单的方法区分这两种物质___________ ___________________________________________________________________________________________________________________________ ________。
________。
③在方案Ⅱ中,三种钠盐用其他物质中的________可加以区分,有关反应的化学方程式分别为_________________________________________________
_________________________________________________________________。
④该兴趣小组中的一位同学认为,还可以根据是否含有钠元素将上述六种物质分为Na2SO3、Na2CO3、NaCl、NaOH和H2SO4、KCl两类。在用H2SO4鉴别四种含钠元素的物质时,Na2SO3和Na2CO3很容易得到了区分,但鉴别NaCl和NaOH时却陷入了困境,请设计一个实验来解决这一难题:__________ ______________________________________________________________________ ______________________________________________________________
______________________________________________________________
___________________________________________________________________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
NA为阿伏加德罗常数,下列说法正确的是
A.1 mol碳正离子(CH3+)所含的电子总数为9NA
B.28g乙烯所含共用电子对数目为4NA
C.标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA
D.现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com