
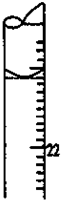
 某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol•L-1标准氢氧化钠溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:分析 (1)滴定管需要润洗2-3次;
(2)如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析不当操作对相关物理量的影响,以此判断浓度的误差.
(4)滴定管的刻度由上而下刻度增大,精度为0.01mL,据此结合图象读数;
(5)根据反应:HCl+NaOH=NaCl+H2O求出盐酸的浓度.
解答 解:(1)滴定管装液前需用所装溶液润洗,所装A步操作为用标准氢氧化钠溶液润洗滴定管2-3次;
故答案为:用标准氢氧化钠溶液润洗滴定管2-3次;
(2)本实验是用NaOH滴定盐酸溶液,用酚酞作指示剂,所以终点时,现象是当溶液由无色变为浅红色,且在半分钟内不褪色;
故答案为:溶液由无色变为浅红色,且半分钟内不褪色;
(3)若先用待测溶液润洗锥形瓶,会使锥形瓶内溶质的物质的量增大,会造成V(标准)偏大,根据c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析,会造成结果偏高;
故答案为:偏大;
(4)滴定管的刻度由上而下刻度增大,精度为0.01mL,由图可知终点读数为21.10mL;
故答案为:21.10;
(5)消耗标准NaOH溶液的体积为21.10mL-3.10mL=18.00mL;
HCl~NaOH
1 1
c(HCl)×20.00mL 0.1000mol•L-1×18.00mL
解得:c(HCl)=$\frac{0.1000mol•{L}^{-1}×18mL}{20.00mL}$=0.09000mol•L-1
故答案为:0.09000mol•L-1.
点评 本题考查酸碱中和滴定实验,题目难度不大,注意把握实验的原理、步骤、方法以及注意事项,把握实验基本操作.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/mol•L-1 | c(H2SO4)/mol•L-1 |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.1 | 0.2 |
| ③ | 50 | 0.2 | 0.1 |
| ④ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 实验温度/℃ | c(Na2S2O3)/(mol•L-1) | c(H2SO4)/(mol•L-1) |
| ① | 25 | 0.1 | 0.1 |
| ② | 25 | 0.2 | 0.1 |
| ③ | 25 | 0.1 | 0.2 |
| ④ | 50 | 0.2 | 0.1 |
| ⑤ | 50 | 0.1 | 0.1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.
某化学兴趣小组的甲、乙两位同学对测定化学反应速率非常感兴趣,为此进行了有关的实验探究,实验记录如下.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜离子 | |
| C. | 某反应的△H>0、△S<0,则该反应一定不能正向进行 | |
| D. | 为加快漂白精的漂白速率,使用时可滴加几滴醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 化学反应除了生成新的物质外,只伴随着热量的变化 | |
| B. | 物质燃烧不一定是放热反应,放热的化学反应不需要加热就能发生 | |
| C. | 太阳能、氢能、生物质能属于新能源 | |
| D. | 化石燃料是一次能源,乙醇是不可再生能源 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com