
【题目】如图所示是一种以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。
下列说法正确的是

A. 电池内的O2-由电极乙移向电极甲
B. 电池总反应为N2H4+2O2=2NO+2H2O
C. 当甲电极上有1molN2H4消耗时,乙电极上有1mol被氧化
D. 电池外电路的电子由电极乙移向电极甲
科目:高中化学 来源: 题型:
【题目】为保持街道整洁、湿润,在路面或广场上喷洒含化学式为XY2的溶液作保湿剂。X原子的结构示意图为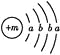 ,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
,X的阳离子与Y的阴离子的电子层结构相同。元素Z、W均为短周期元素,它们原子的最外层电子数均是其电子层数的2倍,Z与Y相邻且Z、W能形成一种WZ2型分子。
(1)m= ,该保湿剂的化学式为
(2)Z、W元素的名称为 、
(3)下列说法中正确的是
A.XY2和WZ2都为离子化合物
B.XY2中仅含离子键,WZ2中仅含极性共价键
C.H2Z比HY的稳定性强
D.X的阳离子比Y的阴离子半径大
(4)下列化学用语表达正确的是
A.XY2的电子式:X2+![]()
B.WZ2的结构式:Z=W=Z
C.Y元素的单质与H2Z水溶液反应的离子方程式为:Y2+Z2-2Y-+Z↓
D.用电子式表示XY2的形成过程为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙是一种温和的氧化剂,常温下为白色的固体,易溶于酸,难溶于水、乙醇等溶剂。某实验小组拟选用如下装置(部分固定装置略)制备过氧化钙。
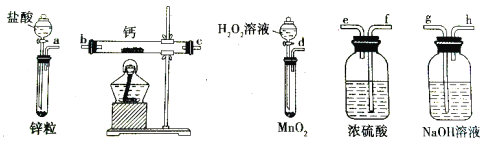
(1)请选择必要的装置,按气流方向连接顺序为____________(填仪器接口的字母编号,装置可重复使用)。
(2)根据完整的实验装置进行实验,实验步骤如下:①检验装置的气密性后,装入药品;②打开分液漏斗活塞,通入一段时间气体,加热药品;③反应结束后,________(填操作);④拆除装置,取出产物。
(3)若钙在空气中燃烧生成氮化钙(Ca3N2),同时可能生成过氧化钙。请利用下列试剂, 设计实验检验钙的燃烧产物中是否含有过氧化钙________________。(简要说明实验步骤、现象和结论)
限选试剂:酸化的FeCl2溶液、NaOH溶液、KSCN溶液、稀硝酸
(4)利用反应Ca2++H2O2+2NH3+8H2O===CaO2·8H2O↓+2NH4+,在碱性环境下制取CaO2的装置如下:
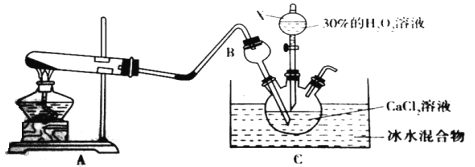
C中沉淀反应时常用冰水浴控制温度在0℃左右,其可能的原因分析:
该反应是放热反应,温度低有利于提高CaO2·8H2O产率;
_______________ ______________。
(5)测定产品中CaO2含量的实验步骤如下:
步骤一:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的bg KI晶体,再滴入少量2mol·L-1的硫酸,充分反应。
步骤二:向上述锥形瓶中加入几滴________(作指示剂)。
步骤三:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,滴定至终点,记录数据,再重复上述操作2次,得出三次平均消耗Na2S2O3,溶液体积为V mL。
CaO2的质量分数为________(用字母表示)。[已知:I2+2S2O32-=2I-+S4O62-]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】OPA可用作内窥镜手术用器械抗菌消毒剂,也用于合成新抗血小板聚集药吲哚波芬。由烃A合成OPA的转化关系如图所示。
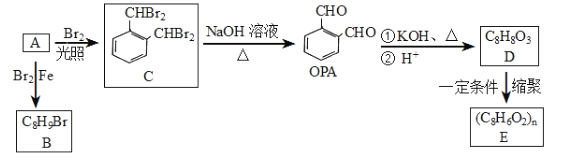
回答下列问题:
(1)下列关于A的说法正确的是__________(填字母)。
a.与苯互为同系物 b.能与溴水发生加成反应
c.能使酸性高锰酸钾溶液褪色 d.能发生加聚反应生成高分子化合物
(2)A→B的反应类型为________________。
(3)OPA的化学名称为________________。
(4)C中所含官能团的名称为______________。
(5)E是一种聚酯类高分子化合物,由D生成E的化学方程式为_____________________。
(6)D的同分异构体中,含有苯环且苯环上只有两个取代基,能水解且能与FeC13溶液 发生显色反应的有________种,其中能发生银镜反应且核磁共振氢谱只有5组峰的是 ___________(填结构简式)。
(7)写出以甲苯为原料(其他无机试剂任选)制备苯甲酸苯甲酯的合成路线:__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%。

(1)当温度由T1变化到T2时,平衡常数关系K1___________K2(填“>”,“<”或“=”),焓变△H___________0.(填“>”或“<”)
(2)该反应在T1温度下5.0min达到平衡,这段时间内N2的化学反应速率为___________,N2的转化率___________;
(3)T1温度下该反应的化学平衡常数K1=___________;
(4)T1温度时,若测得高炉中c(N2)=0.5mol/L,c(H2)=0.5mol/L,c(NH3)=0.5mol/L在这种情况下,该反应是否处于平衡状态___________(填是或否),此时反应速率是v正___________v逆(填>,<,=);
Ⅱ.根据最新研究报道,在常温常压和光照条件下N2在催化剂表面与水发生反应:2N2(g)+6H2O(l)=4NH3(g)+3O2(g)。
(1)此反应的△S 0(填“>”或“<”)。
已知2CO(g)+2NO(g)=N2(g)+2CO2(g) △H="-a" kJ·mol-1
2NO(g)+O2(g)=2NO2(g) △H ="-b" kJ·mol-1;CO的燃烧热△H ="-c" kJ·mol-1。
(2)写出消除汽车尾气中NO2的污染时,NO2与CO的反应的热化学反应方程式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)除去铁粉中混有的铝粉选用试剂:___________,离子方程式:___________。
(2)盛放烧碱等碱性溶液不宜用磨口玻璃塞,相应的离子方程式为:___________。
(3)用稀盐酸清洗铜器皿表面上的铜锈的方程式为___________。
(4)实验室配制好的硅酸钠溶液保存过程中变质相应化学方程式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为A1203,还含有Fe203、Si02)提取氧化铝,冶炼铝的原料,提取的操作过程如下:
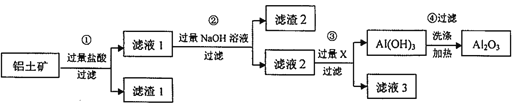
请回答下列问题:
(1)写出步骤①中发生反应的离子方程式_______;滤渣①的成分为________。
(2)写出步骤②中生成含铝化合物的化学方程式__________________;能否将此步骤中的NaOH 溶液更换为氨水?_________(填“能”或“不能”)。若不能,请说明理由:_________(若能,则此空不答)。
(3)步骤③中的X 为______(填化学式),发生反应的离子方程式为_______。
(4)若铝土矿的质量为mkg,最后得到A12O3的质量为nkg(忽略提取过程中铝元素的损失),则铝土矿中铝元素的质量分数为_____________(用含m、n 的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com