
(1)固体NH5的电子式为__________________________。
(2)NH5溶于水后,溶液呈___________性(填“酸”“碱”或“中”)。写出NH5与水反应的化学方程式_____________________________。
(3)NH5与铜或铜的某种化合物在一定条件下可生成CuH。CuH是一种难溶物,它能与盐酸反应,生成一种单质气体和一种难溶于水的白色固体。试写出CuH与盐酸反应的化学方程式____________________________。
(1)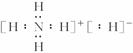
(2)碱
NH4H+H2O====NH3·H2O+H2↑
(3)CuH+HCl====CuCl↓+H2↑
解析:NH5是由1个![]() 原子与5个·H原子作用形成的,分析它们采取何种方式才能实现稳定电子结构,可知NH5应是由
原子与5个·H原子作用形成的,分析它们采取何种方式才能实现稳定电子结构,可知NH5应是由![]() 与H-形成的离子化合物。
与H-形成的离子化合物。
(1)NH5的电子式为 。
。
(2)NH4H溶于水电离出的![]() 、H-与H2O电离出的H+、OH-阴、阳离子重组,
、H-与H2O电离出的H+、OH-阴、阳离子重组,![]() 与OH-组合为NH3·H2O,H-与H+组合后发生氧化还原反应而变为H2,反应的方程式为NH4H+H2O====NH3·H2O+H2↑,所得溶液为氨水,显碱性。(3)CuH与HCl进行阴、阳离子重组,反应方程式为CuH+HCl====CuCl↓+H2↑。
与OH-组合为NH3·H2O,H-与H+组合后发生氧化还原反应而变为H2,反应的方程式为NH4H+H2O====NH3·H2O+H2↑,所得溶液为氨水,显碱性。(3)CuH与HCl进行阴、阳离子重组,反应方程式为CuH+HCl====CuCl↓+H2↑。


科目:高中化学 来源: 题型:
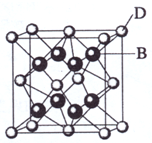
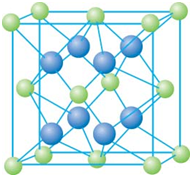 已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:
已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B形成的晶体其晶胞结构如图,图中小球代表D,大球代表B.请回答:


| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
| 4×78g/mol |
| ag/cm3×6.02×1023/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
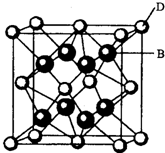
 (2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.
(2009?海南)已知A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数依次增大.A与其他4种元素既不在同一周期又不在同一主族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第7列元素.D的原子序数比E小5,D跟B可形成离子化合物其晶胞结构如右图.| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
| 4×78g/mol |
| ag?cm-3×6.02×1023/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素.D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图.请回答:
已知A、B、C、D、E都是元素周期表中前36号的元素,其原子序数依次增大.A与其他4种元素既不在同一周期又不在同一族.B和C属同一主族,D和E属同一周期,又知E是周期表中1-18列中的第8列元素.D的原子序数比E小6,D跟B可形成离子化合物其晶胞结构如图.请回答:| 8b+4c |
| aNA |
| 8b+4c |
| aNA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学一一选修物质结构与性质】
【化学一一选修物质结构与性质】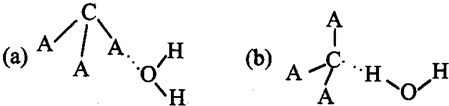
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com