
| 实验编号 | I–的初始浓度 (mol·L-1) | OCl–的初始浓度 (mol·L-1) | OH–的初始浓度 (mol·L-1) | 初始速率v (mol·L-1· s-1) |
| 1 | 2 × 10–3 | 1.5 × 10–3 | 1.00 | 1.8 × 10–4 |
| 2 | a | 1.5 × 10–3 | 1.00 | 3.6 × 10–4 |
| 3 | 2 × 10–3 | 3 × 10–3 | 2.00 | 1.8 × 10–4 |
| 4 | 4 × 10–3 | 3 × 10–3 | 1.00 | 7.2 × 10–4 |
 ,解得V是50ml。所以碱的体积是50ml-5ml-5ml=40ml,因此
,解得V是50ml。所以碱的体积是50ml-5ml-5ml=40ml,因此 ,解得c=1.25mol/L。
,解得c=1.25mol/L。

科目:高中化学 来源:不详 题型:实验题

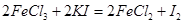 ,用淀粉作指示剂,用
,用淀粉作指示剂,用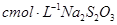 溶液进行滴定
溶液进行滴定 ,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56 Cl:35.5)
,消耗Na2S2O3溶液VmL,则样品中FeCl3的质量分数为____。(相对原子质量Fe:56 Cl:35.5)查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CrO42-+2H+左移,导致滴定终点滞后。
2CrO42-+2H+左移,导致滴定终点滞后。| 实验序号 | FeSO4溶液的体积读数/mL | |
| 滴定前 | 滴定后 | |
| 1 | 0.10 | 16.20 |
| 2 | 0.30 | 15.31 |
| 3 | 0.20 | 15.19 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 。(填写化学式或分子式)
。(填写化学式或分子式) 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 装置 |  |  |  |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.乙烷和氯气光照下制取纯净的氯乙烷 | B.用分液漏斗分离环己烷和水的混合液体 |
| C.用浓氨水洗涤做过银镜反应的试管 | D.在苯和溴水的混合物中加入铁粉制取溴苯 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.只有①⑤ | B.只有③④⑤ | C.只有①②③⑤ | D.①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 滴定次数 | 盐酸体积(mL) | NaOH溶液体积读数(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.00 | 18.10 |
| 2 | 20.00 | 0.00 | 16.30 |
| 3 | 20.00 | 0.00 | 16.22 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com