
 氟是非金属性最强的元素.
氟是非金属性最强的元素.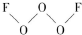 ,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.
,其中氧原子采用的轨道杂化方式是sp3,又如O2F2是一种强氧化剂,运用VSEPR模型判断O2F2是极性(填“极性”或“非极性”)分子.分析 (1)F原子核外有9个电子,核外电子排布式为1s22s22p5,最外层电子为价电子,最高能级为2p能级;
(2)氧原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4;
(3)Cl原子形成4个σ键,没有孤电子对,为四面体构型;
(4)冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+、[AlF6]3-构成,[AlF6]3-中含有配位键;
(5)HF分子之间存在氢键形成缔合(HF)n分子;
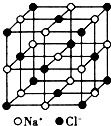
(6)NaCl晶体的晶胞中的所有Cl-离子去掉,并将Na+离子全部换为Ca2+离子,再在其中的8个“小 立方体”中心各放置一个F-离子,氟化钙晶胞中有8个F-离子,Ca2+离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×78}{{N}_{A}}$g,若“大立方体”的边长为a pm,则晶胞体积为(a×10-10 cm)3,根据ρ=$\frac{m}{V}$计算晶体密度;
8个“小立方体”中心的氟离子组成立方体,该立方体的棱长为$\frac{1}{2}$a pm.
解答 解:(1)F原子核外有9个电子,核外电子排布式为1s22s22p5,最外层电子为价电子,价电子排布式为2s22p5,其最高能级为2p能级,电子云形状是哑铃形,该能级电子云在坐标里有3个相互垂直的取向,
故答案为:2s22p5;3;
(2)氧原子形成2个σ键,含有2对孤对电子,杂化轨道数目为4,氧原子采取sp3杂化;O原子的VSEPR模型为四面体,有2对孤电子对,氧原子与之连接的原子为V形结构,不是对称结构,属于极性分子,
故答案为:sp3;极性;
(3)Cl原子形成4个σ键,没有孤电子对,为四面体构型,故答案为:四面体形;
(4)冰晶石(Na3AlF6)晶体不导电,但熔融时能导电,说明属于离子化合物,由Na+、[AlF6]3-构成,[AlF6]3-中含有配位键和极性键,
故选:abc;
(5)常压时,在80℃以下,HF分子之间存在氢键形成缔合(HF)n分子,故HF相对分子质量的实验值明显大于理论值,
故答案为:常压时,在80℃以下,HF分子之间存在氢键形成缔合(HF)n分子;
(6)NaCl晶体的晶胞中的所有Cl-离子去掉,并将Na+离子全部换为Ca2+离子,再在其中的8个“小 立方体”中心各放置一个F-离子,氟化钙晶胞中有8个F-离子,Ca2+离子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则晶胞质量为$\frac{4×78}{{N}_{A}}$g,若“大立方体”的边长为a pm,则晶胞体积为(a×10-10 cm)3,故晶体密度=$\frac{4×78Ω}{{N}_{A}}$g÷(a×10-10 cm)3=$\frac{312}{{a}^{3}{N}_{A}×1{0}^{-30}}$g/cm3;
8个“小立方体”中心的氟离子组成立方体,该立方体的棱长为$\frac{1}{2}$a pm,则8个“小立方体”中心的氟离子组成的图形体积是($\frac{1}{2}$a×10-10 cm)3=$\frac{1}{8}$a3×10-30cm3,
故答案为:$\frac{312}{{a}^{3}{N}_{A}×1{0}^{-30}}$;$\frac{1}{8}$a3×10-30 .
点评 本题是对物质结构与性质的考查,涉及核外电子排布、核外电子运动、杂化方式判断、分子极性、空间构型、化学键、氢键、晶胞计算等,需要学生具备扎实的基础,难度中等.


 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在铁件上镀铜时,金属铜作阳极 | |
| B. | 实验室制氢气用粗锌比用纯锌速率快 | |
| C. | 电解精炼铜时,粗铜电极上每转移0.2 mol e-,阴极析出6.4 g Cu(忽略能量损失) | |
| D. | 甲醇和氧气以及KOH溶液构成的新型燃料电池中,负极反应为:CH3OH+6OH--6e-═CO2+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
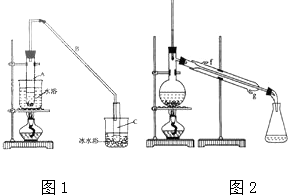 某化学小组以环己醇制备环己烯(如图1),
某化学小组以环己醇制备环己烯(如图1),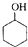 $→_{85℃}^{浓H_{2}SO_{4}}$
$→_{85℃}^{浓H_{2}SO_{4}}$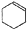 +H2O
+H2O| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴加足量盐酸无规象,再滴加BaCl2溶液有白色沉淀.则原溶液中有SO42- | |
| C. | 某无色溶液滴入酚酞试液显红色,该溶液一定是含有大量的H+ | |
| D. | 某溶液中滴加盐酸生成能使澄清石灰水变浑浊的无色气体,说明原溶液中有CO32- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com