
分析 当反应物的总能量大于生成物的总能量时,反应放热;所有的中和反应均为放热反应;而酸碱中和的实质是氢离子和氢氧根反应生成水,以此解答该题.
解答 解:某化学反应,设反应物的总能量为E1,生成物的总能量为E2,而当反应物的总能量大于生成物的总能量时,故若E1>E2,反应为放热反应;所有的中和反应均为放热反应;而酸碱中和的实质是氢离子和氢氧根反应生成水,即:H++OH-═H2O.
故答案为:放;放;酸电离出的H+与碱电离出的OH-结合生成弱电解质水:H++OH-═H2O.
点评 本题考查反应热与焓变,为高频考点,侧重考查双基知识,题目涉及反应吸放热和反应物、生成物的总能量的关系以及常见的吸放热反应,难度不大,注意基础的掌握.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动了 | B. | 物质A的转化率减少了 | ||
| C. | 物质B的质量分数减小了 | D. | m 小于n |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
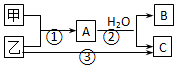
| A. | 若C为酸性气体,则B可能具有两性 | |
| B. | 若C是碱性气体,则B一定是碱 | |
| C. | 若B、C是两种酸,则B、C一定都是一元酸 | |
| D. | 以上3个转变可能都是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
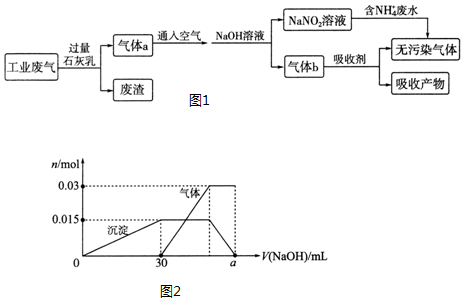
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验操作 | 预期现象 | 结论 |
| 实验1:在试管A加入少量乙醚,充分振荡,静置 | 乙醚层呈红色 | “猜想一”不成立 |
| 实验2:取萃取后的上层清液滴加2-3滴 K4[Fe(CN)6]溶液 | 若产生蓝色沉淀 | 则“猜想二”成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13C与15N有相同的中子数 | B. | 13C的质子数为13 | ||
| C. | 15N与14N互为同位素 | D. | 15N的核外电子数与中子数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
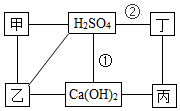 图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )
图中每条连线表示两端的物质可以发生化学反应,甲、乙、丙、丁分别为Mg、BaCl2、Na2CO3、HCl中的一种,下列说法正确的是( )| A. | 甲是Na2CO3 | B. | 乙是Mg | ||
| C. | 反应①②是非氧化还原反应 | D. | 丙与丁发生反应时,丁是还原剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com