
| 编号 | 0.02mol/LNaHSO3溶液/mL | 0.02mol/LKIO3溶液/mL | H2O/mL | 反应温度/℃ | 溶液变蓝的时间t/s |
| ① | 10 | 15 | a | 10 | t1 |
| ② | 10 | 40 | 0 | 10 | t2 |
| ③ | 10 | b | 0 | 20 | t3 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| | |
| △C |
| △t |
| △C |
| △t |
| ||
| 65S |
| 2n |
| 40×10-3×65 |
| 2n |
| 40×10-3×65 |
| 实验方案(不要求写出具体操作过程) | 预期实验现象和结论 |
| 在烧杯甲中将NaHSO3溶液与过量KIO3溶液混合,用测速仪测定其起始时的反应速率v(甲);在烧杯乙中进行同一反应(不同的是乙烧杯中预先加入少量I2单质,其他反应条件均完全相同),测定其起始阶段的相同时间内的反应速率v(乙). | 若v(甲)=v(乙),则假设一不成立;若v(甲)<v(乙),则假设一成立 |


科目:高中化学 来源: 题型:
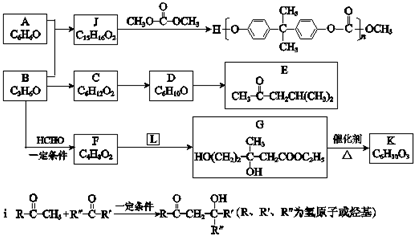
| 催化剂 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
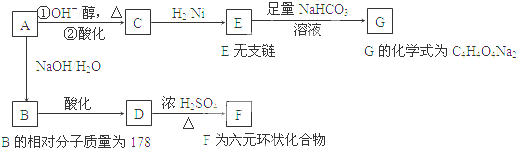
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:
如图所示,把试管放入盛有25℃饱和石灰水的烧杯中,试管开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,它的分子式是
,它的分子式是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.12g |
| B、3.18g |
| C、4.22g |
| D、5.28g |
查看答案和解析>>
科目:高中化学 来源: 题型:
 材料的不断发展可以促进社会进步.
材料的不断发展可以促进社会进步.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com