
���� ��1������ˮ����2Na+2H2O=2NaOH+H2�����Ƶ��ܶȱ�ˮС���۵�ͣ��ܺ�ˮ���ҷ�Ӧ�����������Դ˿��жϷ�Ӧ����
��2���������������ۻ��������ɵ��������������ۻ���Al�����棬ʹAl�����䣻
��3��Al��Al2O3��NaOH��Ӧ������NaAlO2��
��4��Na��ˮ��Ӧ����NaOH��H2��NaOH��Al��Ӧ����H2��NaAlO2���䷽��ʽΪNa+Al+2H2O=NaAlO2+2H2��������Na������֮��Ĺ�ϵʽ���㣮
��� �⣺��1������ˮ����2Na+2H2O=2NaOH+H2����a���Ƶ��ܶȱ�ˮС��Ӧ����ˮ���ϣ���a����
b���Ƶ��۵�ϵͣ���Ӧ���ȣ������۳�С��b��ȷ��
c������������������С���Ĵ��ζ�����c��ȷ��
d�����������������Ĵ��ζ�������Ϊ��ȼ�����壬���Բ�����˻˻����������d��ȷ��
�ʴ�Ϊ��2Na+2H2O=2NaOH+H2����bcd��
��2�����������۵�������۵�ߣ���ס���ۻ����������Լ���������ʱ�����ۻ��˵��Dz�����䣬
�ʴ�Ϊ������Ĥ�۵�ߣ�����ʱ����Ĥ�����ŵ��ڲ��ۻ�������������䣻
��3�������ʻ��ã��ױ����������������������ͼӦΪ��Al2O3+2NaOH=2NaAlO2+H2O�����ӷ�ӦΪ��Al2O3+2OH-=2AlO2-+H2O������NaOH��Һ��Ӧ����ƫ�����ƺ���������ѧ��ӦΪ��2Al+2NaOH+2H2O=2NaAlO2+3H2�������ӷ���ʽΪ��2Al+2OH-+2H2O=2AlO2-+3H2����
�ʴ�Ϊ��Al2O3+2OH-=2AlO2-+H2O��2Al+2OH-+2H2O=2AlO2-+3H2����
��4��Na��ˮ��Ӧ����NaOH��H2��NaOH��Al��Ӧ����H2��NaAlO2���䷽��ʽΪNa+Al+2H2O=NaAlO2+2H2�������ݷ���ʽ֪��0.1molNa��ȫ��Ӧ����V��H2��=2n��Na����Vm=2��0.1mol��22.4L/mol=4.48L��1.12L��
��ѡC��
���� ���⿼�����ơ����������仯��������ʣ���Ŀ�Ѷ��еȣ�ע�����������ơ������仯��������ʣ��״�����ǣ�4����©��Al��NaOH��Һ�ķ�Ӧ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѹ�³���ϡ������ | B�� | ��С��Ӧ��������� | ||
| C�� | ���߷�Ӧ�¶� | D�� | ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO��Ħ������28g/mol | |
| B�� | 1molCO������������Ϊ6.02��1023�� | |
| C�� | 1mol CO��������28g | |
| D�� | ���³�ѹ�£�1mol CO�����Ϊ22.4 L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | �������� | C�� | �������� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����Ȼ�����Һ��Ӧ��Fe+Fe3+�T2Fe2+ | |
| B�� | �Ȼ�����Һ������������������Һ��Ӧ��Al3++3OH-�TAl��OH��3�� | |
| C�� | ����������������Һ��Ӧ��Cl2+2OH-�TCl-+ClO-+H2O | |
| D�� | ̼��������Һ��ϡ���ᷴӦ��2H++CO32-�TCO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���� | B�� | ʯī | C�� | �辧�� | D�� | ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Һ���������ӵ�������ͬ | B�� | ��Һ��pH��ͬ | ||
| C�� | ���������ᷴӦ�ų�CO2���� | D�� | ����ʹ����ʯ��ˮ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
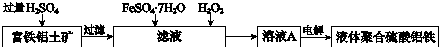
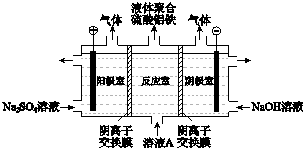 �ӽ���Ĥֻ����������ͨ�����缫Ϊ���Ե缫��
�ӽ���Ĥֻ����������ͨ�����缫Ϊ���Ե缫���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ˮ | B�� | CH3OH | C�� | CS2 | D�� | CH3COOH |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com