
分析 假设O2和O3的质量均为48g,根据n=$\frac{m}{M}$计算各自物质的量,分子数目之比等于其物质的量之比,均由O原子构成,则氧原子质量相等,含有O原子数目相等.
解答 解:假设O2和O3的质量均为48g,
则O2的物质的量为$\frac{48g}{32g/mol}$=1.5mol,
O3的物质的量为$\frac{48g}{48g/mol}$=1mol,
故O2和O3所含分子个数比为1.5mol:1mol=3:2;
O2和O3均由O原子构成,则氧原子质量相等,含有O原子数目相等,即原子个数比为1:1,
故答案为:3:2;1:1.
点评 本题考查物质的量有关计算,侧重考查学生计算能力,明确各个物理量之间关系是解本题关键,注意:相同质量的同素异形体其原子个数相等,题目难度不大.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量g/mol | B. | 气体摩尔体积L/mol | ||
| C. | 溶解度g/100g | D. | 物质的量浓度mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化铝受热分解时吸收燃烧物表面的热量 | |
| B. | 氢氧化铝分解生成的水蒸气稀释燃烧物表面的氧气 | |
| C. | 氢氧化铝受热分解吸收热量使可燃物的着火点降低 | |
| D. | 氢氧化铝分解生成的氧化铝覆盖在燃烧物表面,使燃烧物与O2隔绝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
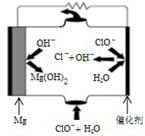 利用所学知识回答下列问题
利用所学知识回答下列问题| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com