
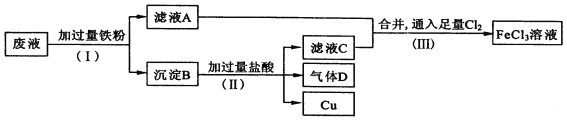
����Ŀ��A����.���ӹ�ҵ����FeCl3��Һ��ʴ��Ե���ϵ�ͭ��������ӡˢ��·�塣�Ӹ�ʴ��Һ(��Ҫ��FeCl3��FeCl2��CuCl2 )�л���ͭ�������»��FeCl3��Һ����Һ�����������£�
(1)����(��)�з�����Һ�ͳ����IJ���������____________________��
(2)����B����Ҫ��������__________������D��_________________��
(3)д������(��)������FeCl3�Ļ�ѧ����ʽ_____________________________��
(4)ȡ��������������Һ�μ�____________(����KSCN��Һ������ϡ������)����Һ�ʺ�ɫ��֤����Fe3+���ڣ�д���÷�Ӧ�����ӷ���ʽ___________________��
���𰸡����� Cu(��ͭ) H2 (������) 2FeCl2 + Cl2=2FeCl3 KSCN��Һ Fe3+ +3SCN-- = Fe(SCN)3
��������
��ʴ��Һ��Ҫ��FeCl3��FeCl2��CuCl2��ת����ϵͼ��֪:���Һ�м�����������ۣ�������ӦFe+2FeCl3=3FeCl2��Fe+CuCl2= FeCl2 +Cu������ҺAΪFeCl2��Һ������BΪCu��Fe�������B�мӹ������ᣬ������ӦFe+2HCl= FeCl2+H2��������ҺCΪFeCl2��HCl�Ļ����Һ������DΪH2������ҺA����ҺC�ϲ���ͨ��������Cl2��������Ӧ2FeCl2 +Cl2 =2FeCl3��
(1)������(��)�ǽ����������Һ���룬���������ǹ��ˣ�
�ʴ�Ϊ�����ˣ�
(2)������B����Ҫ����Cu��Fe������D��H2��
�ʴ�Ϊ��Cu(��ͭ)��H2 (������)��
(3)������(��) ��FeCl2��Cl2��Ӧ����FeCl3����ѧ����ʽΪ��2FeCl2 + Cl2=2FeCl3��
�ʴ�Ϊ��2FeCl2 + Cl2=2FeCl3��
(4)��Fe3+��KSCN��Һ��죻
�ʴ�Ϊ��KSCN��Һ��Fe3+ +3SCN-- = Fe(SCN)3��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ֿ��ɷ�ȩ��֬�Ͳ�����ά�Ƴɡ�
��1����ȩ��֬�б��Ӻͼ�ȩ���۶��ɣ���Ӧ�д����ȷų���Ϊ��ֹ�¶ȹ��ߣ�Ӧ�����б��ӵķ�Ӧ����__�����ȩ���ҷ�Ӧ��Ӧװ��__װ�ã�
��2��������ά�ɲ�����˿�õ�����ͨ��������ʯӢɰ��__��ʯ��ʯ����ʯ���������ڶ��ɣ���Ҫ��Ӧ�Ļ�ѧ����ʽΪ__��
��3���������в�����ά��������__�������־���___���������ܣ�д�����㼴�ɣ���
��4�����д����Ͼ��ȹ��Է�ȩ���ϵ�������������__��
a������ b�������������֬����
c������ȼ�� d�����л��ܼ������ܽ⣬������֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ⱥ����ܱ�������ͨ��SO2��NO2��һ��������ʹ��ӦSO2��g��+NO2��g��SO3��g��+NO��g���ﵽƽ�⣬����Ӧ������ʱ��仯��ʾ��ͼ������ʾ����ͼ�ɵó�����ȷ�����ǣ� ��
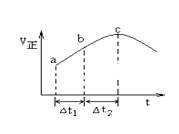
A.��Ӧ��c��ﵽƽ��״̬
B.��Ӧ��Ũ�ȣ�a��С��b��
C.��Ӧ��������������������������
D.��t1=��t2ʱ��SO2��ת���ʣ�a��b��С��b��c��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ķ���ϩ��Ʒ����Ϊ���ط�������������ճ��Ϳ�㡣����һ�����壬�þ�����һ����ƽ�����������ϸ�����λ����Ķ��ؾ��塣��ͨ��___�������־��塢����ͷǾ��塣
��2�����е�ԭ�ӵĵ����Ų�ͼ��ʾ��״̬�У������ɵ͵��ߵ�˳����___(����ĸ����)��
A.![]() B.
B.![]()
C.![]() D.
D.![]()
��3��ij���˵�����ľ���ṹ��NaCl�͡�NaCl��Bom-Haberѭ����ͼ��ʾ����֪��Ԫ�ص�һ����̬ԭ�ӻ�õ��ӳ�Ϊ��̬������ʱ���ų���������Ϊ�������ܡ������й�˵����ȷ����__(����)��
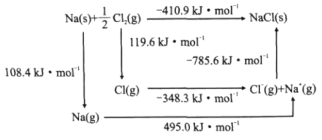
a.Cl-Cl���ļ���Ϊ119.6kJ/mol b.Na�ĵ�һ������Ϊ603.4kJ/mol
c.NaCl�ľ�����Ϊ785.6kJ/mol d.Cl�ĵ�һ��������Ϊ348.3kJ/mol
��4�������[Cu(En)2]SO4��������������Ҷ�����ͭ(��)����ͭ��һ����Ҫ���������En ���Ҷ���(H2N-CH2-CH2-NH2)�ļ�д��
�ٸ�������к��л�ѧ����___������ĸ��ţ���
A�����Ӽ� B�����Թ��ۼ� C���Ǽ��Թ��ۼ� D����λ�� E.������
�������Ҷ��������е�ԭ�ӡ�̼ԭ�ӹ�����ӻ����ͷֱ�Ϊ___��___��
���Ҷ��������װ�[N(CH3)3]�����ڰ�������Է���������������Ҷ��������װ��ķе�ߵö࣬ԭ����___��
���Ҷ���(H2NCH2CH2NH2)��һ���л�������Ҷ�������Mg2+��Cu2+�Ƚ��������γ��ȶ���״���ӣ���ԭ����___���������Ҷ����γɵĻ������ȶ�����Խϸߵ���___(����Mg2+������Cu2+��)��
���백����Ϊ�ȵ������������Ϊ___����Sλ��ͬһ���ڣ��ҵ�һ������С��S�ķǽ���Ԫ�ط���Ϊ___��
��5���ٽ����ѵ�ԭ�Ӷѻ���ʽ��ͼ1��ʾ��������Ѿ�������ͼΪ____��

A. B.
B. C.
C. D.
D.
��ij�����Ͻ�ľ�����ͼ��ʾ���谢���ӵ�������ֵΪNA���þ�����ܶ�����__g��cm��3��
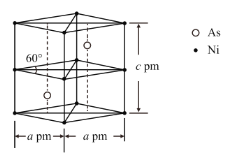
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����û�ѧ��Ӧԭ���о��������ȵ��ʼ��仯����ķ�Ӧ����Ҫ���塣
��1���ϳɰ���Ӧ��ӦN2(g)+3H2(g)![]() 2NH3(g)�����ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ��_______�ƶ�����������������������������������ʹ�ô���_____��Ӧ����H����������������С���������ı�������
2NH3(g)�����ں��¡���ѹ��������ƽ����ϵ��ͨ�������ƽ��_______�ƶ�����������������������������������ʹ�ô���_____��Ӧ����H����������������С���������ı�������
��2��O2(g)= O+2(g)+e- ![]() H1=1175.7kJ��mol-1
H1=1175.7kJ��mol-1
PtF6(g)+ e-1![]() PtF6-(g)
PtF6-(g)![]() H2= -771.1 kJ��mol-1
H2= -771.1 kJ��mol-1
O2+PtF6-(s)=O2+(g)+PtF6- ![]() H3=482.2 kJ��mol-1
H3=482.2 kJ��mol-1
��ӦO2��g��+ PtF6 (g) = O2+PtF6- (s)��![]() H=_____________ kJ��mol-1��
H=_____________ kJ��mol-1��
��3����25���£���Ũ�Ⱦ�Ϊ0.1 mol��L-1��MgCl2��CuCl2�����Һ����μ��백ˮ��������__________�������ѧʽ�������ɸó��������ӷ���ʽΪ____________����֪25��ʱKsp[Mg(OH)2]=1.8��10-11,KsP[Cu(OH)2]=2.2��10-20��
��4����25���£���a mol��L-1�İ�ˮ��0.01 mol��L-1������������ϣ���Ӧƽ��ʱ��Һ��c(NH4+)=c(Cl-)������Һ��_____________�ԣ����������������������������ú�a�Ĵ���ʽ��ʾNH3��H2O�ĵ��볣��Kb=__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��WΪԭ���������������ֶ�����Ԫ�أ�����Y��ZΪ����Ԫ�ء�X��Y��Z��W������������Ӧ��ˮ����ס��ҡ�������֮�������ͼ��ʾ��Ӧ��ϵ(��ϵͼ�С��������������������ܷ�����Ӧ���������ж���ȷ����

A. X��Ԫ�����ڱ��зǽ�������ǿ��Ԫ�� B. Zλ��Ԫ�����ڱ���3����IA��
C. ����ԭ���У�Yԭ�Ӱ뾶��С D. W�ļ������ӿ��ܴٽ�ˮ�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ȡŨ�Ⱦ�Ϊ0.1 mol��L1�Ĵ�����Һ�Ͱ�ˮ��20 mL���ֱ���0.1 mol��L1 ����������Һ��0.1 mol��L1��������к͵ζ����ζ�������pH��μ���Һ������仯��ϵ��ͼ��ʾ������˵����ȷ����
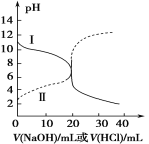
A.����I���μ�10 mL��Һʱ��c(NH4+)+c(H��)��c(OH��)+c(NH3��H2O)
B.����I���μ�20 mL��Һʱ������Һǡ����ȫ��Ӧ����ʱ��Һ��pH<7
C.����II���μ���Һ�����10��20 mL֮��ʱ���ڣ�c(NH4+)��c(Cl��)>c(OH��)��c(H��)
D.����II���μ�30 mL��Һʱ��c(CH3COO��)>c(Na��)>c(OH��)>c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ����ʵ��������������ԭ�����͵���
A.���Ƶ���ˮ�ڹ�������ɫ��dz
B.H2��I2��HIƽ��������ѹ����ɫ����
C.�ںϳɰ��ķ�Ӧ�У���ѹ�����ڰ��ĺϳ�
D.Fe��SCN��3��Һ�м���NaOH����Һ��ɫ��dz
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com