
少量铁粉与100 mL 0.01 mol·L-1的稀盐酸反应,反应速率太慢。为了加快此反应速率而不改变H2的产量,可以使用如下方法中的
①加H2O ②加CH3COONa固体 ③改用10 mL 0.1 mol·L-1盐酸
④滴入几滴硫酸铜溶液 ⑤升高温度(不考虑盐酸挥发)
A.①② B.②③ C.③⑤ D.④⑤
科目:高中化学 来源: 题型:
写出下列反应的离子方程式:
(1)铁粉加入CuSO4溶液中:
________________________________________________________________________,
(2)Cl2通入石灰水中:
________________________________________________________________________,
(3)漂白粉溶液与空气中CO2反应:
________________________________________________________________________,
(4)向沸水中滴加少量FeCl3溶液制备Fe(OH)3胶体:
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是实验室制取并验证SO2的某些性质的装置图。试回答:
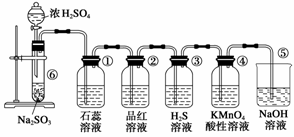
(1)在⑥中发生反应的化学方程式为
________________________________________________________________________
________________________________________________________________________。
(2)在①中的实验现象为___________________________________________________,
此实验证明SO2是________气体。
(3)②中的品红溶液_____________________________________________________,
证明SO2有________________。
(4)③中的实验现象是_____________________________________________________,
证明SO2有____________性。
(5)④中的实验现象是___________________________________________________,
证明SO2有____________性。
(6)⑤的作用是_________________________________________________________,
反应的化学方程式为_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
A.强电解质溶液一定比弱电解质溶液的导电性强
B.强电解质的水溶液中不存在分子
C.SO2和乙醇均属共价化合物,在水中都不能电离,均属非电解质
D.不同的弱电解质只要物质的量浓度相同,电离程度也相同
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温恒压下,在容积可变的器皿中,反应2NO2(g) N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
N2O4(g)达到平衡后,再向容器内通入一定量NO2,又达到平衡时,N2O4的体积分数
A.不变 B.增大 C.减少 D.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=2的两种一元酸HX和HY的溶液分别取50mL,加入过量的镁粉,充分反应后,收集H2的体积在相同状况下分别为V1和V2,若V1>V2,下列说法正确的是
A.HX可能是强酸 B.NaX水溶液的碱性弱于NaY水溶液的碱性
C.HX一定是弱酸 D.反应过程中二者生成H2的速率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。
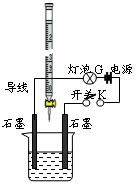 为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如右图所示的实验装置。
为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如右图所示的实验装置。
(1)实验时,烧杯中应盛 ▲ (选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯
中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度
为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。
断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为 ▲ ,原因是 ▲ 。烧杯中得到的溶液pH= ▲ 。
(3) 若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“⑵”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是 ▲ 。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式 为____ ▲ ____。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是___ ▲ ___(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.在熔化状态下能导电的化合物为离子化合物
B.根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
C.CO2、SiO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
D.因为Na2O的水溶液能导电,所以Na2O是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com