
| A. | 能与NaOH溶液反应的同分异构体共有6种 | |
| B. | 存在分子中含有六元环的同分异构体 | |
| C. | 既含有羟基又含有醛基的有5种 | |
| D. | 不存在含有2个羟基的同分异构体 |
分析 A.分子式为C4H8O2的有机物,该有机物能与NaOH溶液反应,则可能是羧酸、也可能是酯;
B.分子式为C4H8O2的六元环: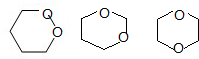 ;
;
C.C4H8O2属于羟基醛时,可以根据官能团的位置异构得到其同分异构体;
D.分子式为C4H8O2的有机物可以含有C=C和2个-OH.
解答 解:A.对于羧酸而言,根据羧基位置异构可以得到两种丁酸;根据酯基位置异构和碳链异构可得:甲酸丙酯2种(丙基2种异构)、乙酸乙酯1种、丙酸甲酯1种,共6种,故A正确;
B.分子式为C4H8O2的六元环: ,所以存在分子中含有六元环的同分异构体,故B正确;
,所以存在分子中含有六元环的同分异构体,故B正确;
C.C4H8O2属于羟基醛时,可以是2-羟基丁醛、3-羟基丁醛、4-羟基丁醛、2-甲基-2-羟基丙醛、2-甲基-3羟基丙醛,共5种同分异构体,故C正确;
D.分子式为C4H8O2的有机物可以含有C=C和2个-OH,其结构简式为:CH2(OH)CH(OH)CH=CH2,故D错误.
故选D.
点评 本题考查同分异构体的种类,根据官能团异构和位置异构和碳链异构来综合分析同分异构体的种数,难度不大,有利于培养学生的逻辑推理能力.


科目:高中化学 来源: 题型:选择题
| A. | 玻璃是透明的属于晶体 | B. | 二氧化硅是制造光导纤维的材料 | ||
| C. | 石灰石是制造陶瓷的主要原料 | D. | 纯碱是制取水泥的主要原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中可能含有K+ | |
| B. | 该溶液中肯定含有NH4+、SO42-、AlO2-、NO3- | |
| C. | 该溶液中一定不含NO3- | |
| D. | 该溶液中一定含K+,且c(K+)≥0.1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA | |
| B. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA | |
| C. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCC14含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
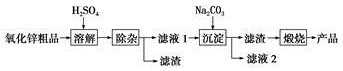
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
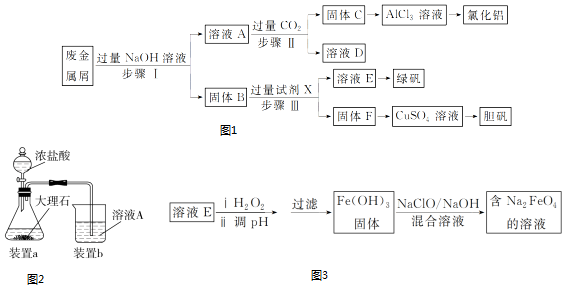
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
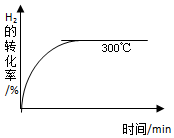 甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)
甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇:2H2(g)+CO(g)?CH3OH(g)| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com