
【题目】工业上用铝土矿(主要成分是Al2O3、Fe2O3、SiO2)提纯Al2O3做冶炼铝的原料,提取的操作过程可用以下流程图表示:
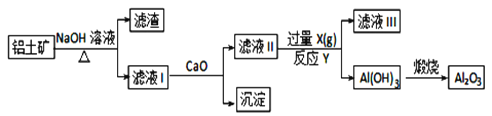
已知:Na2SiO3 + Ca(OH)2= CaSiO3↓+ 2NaOH
(1)氢氧化钠溶液浸取铝土矿时,发生反应的离子方程式有:______________________、______________________。
(2)滤液II中通入过量的气体X是________。反应的化学方程式:____________________。
【答案】SiO2+2OH-=SiO32-+H2O Al2O3+ 2OH- = 2AlO2-+ H2O CO2 NaAlO2+ CO2+ 2H2O=Al(OH)3↓+NaHCO3
【解析】
Fe2O3和氢氧化钠不反应,而氧化铝、二氧化硅能反应,步骤I利用过滤除去Fe2O3,滤渣为氧化铁,滤液I含有偏铝酸钠、硅酸钠,加入氧化钙,硅酸钠与氢氧化钙反应生成硅酸钙沉淀,过滤后,滤液II中含有偏铝酸钠,通入过量的二氧化碳,生成氢氧化铝沉淀和碳酸氢钠,滤液Ⅲ中溶质是碳酸氢钠,加热分解氢氧化铝得到氧化铝。
根据以上分析,(1)氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水,二氧化硅与氢氧化钠溶液反应生成硅酸钠和水,反应的离子方程式分别是:Al2O3 + 2OH- = 2AlO2-+ H2O、SiO2+2OH-=SiO32-+H2O;
(2)滤液II中含有偏铝酸钠,偏铝酸钠能与过量二氧化碳气体反应生成氢氧化铝沉淀和碳酸氢钠,所以步骤②是通入过量的气体X是CO2,反应的化学方程式是:NaAlO2+ CO2+ 2H2O=Al(OH)3↓+ NaHCO。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用一定量的铁与足量的稀H2SO4及足量的CuO制单质铜,有人设计以下两种方案:
①Fe ![]() H2
H2 ![]() Cu , ② CuO
Cu , ② CuO ![]() CuSO4
CuSO4 ![]() Cu 。
Cu 。
若实验过程中,根据一般的实验方法和实验操作规则进行操作,则对两者制得单质铜的量作比较,正确的是
A. 相等 B. ①多 C. ②多 D. 无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下右图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b不满足题目要求的是
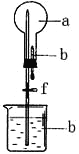
选项 | a(干燥气体) | b(液体) |
A | Cl2 | 饱和NaOH溶液 |
B | SO2 | 4mol/LNaOH溶液 |
C | NO2 | 水 |
D | NH3 | 1mol/L盐酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是宝贵的自然资源。利用海水可以得到一系列产品,也可以进行废气处理。
(1)利用氯碱工业产品来处理含SO2的烟气的流程如图所示:
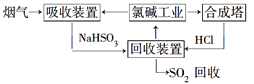
①“吸收装置”中发生反应的离子方程式是__________________________。
②上述流程中循环利用的物质是________。
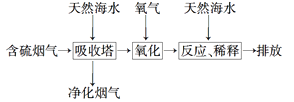
(2)利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是_____________________;氧化后的海水需要加入氢氧化钠,与之混合后才能排放。该操作的主要目的是____________________。
(3)从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是___________。
②要利用MgCl2·6H2O制得无水氯化镁,应采取的措施是________________。
③电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是________(填字母)。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将12.8g铜片加入到100ml一定浓度的硝酸溶液中,铜片完全溶解,产生NO和NO2的混合气体4.48L(标准状况下);若向反应后的溶液中加入400ml、2mol/L NaOH溶液,能使溶液中的Cu2+恰好完全沉淀。下列说法不正确的是
A. 反应后溶液中剩余NO3-的物质的量为0.4mol
B. 原硝酸溶液的物质的量浓度为10mol/L
C. 铜片与硝酸反应过程中转移电子0.4mol
D. 混合气体中NO和NO2的体积之比为1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在粗制CuSO4·5H2O晶体中常含有杂质Fe2+。在提纯时为了除去Fe2+,常加入合适氧化剂,使Fe2+氧化为Fe3+,下列物质可采用的是________。
A. KMnO4 B. H2O2 C. 氯水 D. HNO3
然后再加入适当物质调整至溶液pH=4,使Fe3+转化为Fe(OH)3,可以达到除去Fe3+而不损失CuSO4的目的,调整溶液pH可选用下列中的___________。
A. NaOH B. NH3·H2O C. CuO D. Cu(OH)2
(2)甲同学怀疑调整至溶液pH=4是否能达到除去Fe3+而不损失Cu2+的目的,乙同学认为可以通过计算确定,他查阅有关资料得到如下数据,常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则Cu(OH)2开始沉淀时溶液的pH为________,Fe3+完全沉淀时溶液的pH为________,通过计算确定上述方案________(填“可行”或“不可行”)。
(3)某学习小组用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:取0.800 g试样溶于水,加入过量KI固体,充分反应,生成CuI白色沉淀。用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液40.00 mL。(已知:I2+2S2O![]() ===S4O
===S4O![]() +2I-)。
+2I-)。
①可选用________________作滴定指示剂,滴定终点的现象是________________________。
②CuCl2溶液与KI反应的离子方程式为_______________________________________。
③该试样中CuCl2·2H2O的质量百分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)![]() Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( )
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣=Mn2O3(s)+2OH﹣(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铝土矿为原料,提取氧化铝,冶炼铝的工艺流程如下,下列说法错误的是
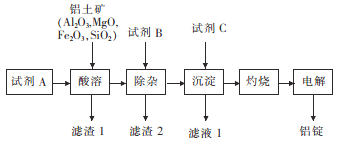
已知:滤渣2主要成分是氢氧化铁、氢氧化镁,B的焰色呈黄色。
A. 试剂A可以是稀硫酸或盐酸 B. 加入试剂B除去Mg2+、Fe3+
C. 滤渣1主要成分是SiO2 D. 电解氧化铝时在阴极上定期补炭块
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 饱和Na2CO3溶液与CaSO4固体反应:CO32+CaSO4![]() CaCO3+SO42
CaCO3+SO42
B. 酸化NaIO3和NaI的混合溶液:I +IO3+6H+![]() I2+3H2O
I2+3H2O
C. KClO碱性溶液与Fe(OH)3反应:3ClO+2Fe(OH)3![]() 2FeO42+3Cl+4H++H2O
2FeO42+3Cl+4H++H2O
D. 电解饱和食盐水:2Cl+2H+![]() Cl2↑+ H2↑
Cl2↑+ H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com