
| c(NH4+) |
| c(NH3?H2O) |


科目:高中化学 来源: 题型:

| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.若X原子中的质子数为a,中子数为b,则X的质量数为:a-b | ||
| B.若弱酸HA的酸性强于弱酸HB,则同物质的量浓度钠盐溶液的碱性比较为:NaA<NaB | ||
C.若将氨水加水稀释,则
| ||
| D.若反应A2+2D-═2A-+D2能发生,则氧化性的比较为:D2>A2 |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年山东省济南市高三(上)期末化学试卷(解析版) 题型:选择题
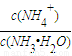 增大
增大查看答案和解析>>
科目:高中化学 来源: 题型:
根据相关化学知识分析,下列推断正确的是
A.若X原子中的质子数为a,中子数为b,则X的质量数为:a―b
B.若弱酸HA的酸性强于弱酸HB,则同物质的量浓度钠盐溶液的碱性比较为:NaA<NaB
C.若R2―和M+的电子层结构相同,则原子序数的比较为:R>M
D.若反应A2+2D―==2A―+D2能发生,则氧化性的比较为:D2>A2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com