
分析 加热发生反应:NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,若NaOH、NaHCO3恰好按1:1反应,固体减少质量为水的质量,根据方程式可知,生成水的质量=20.8g×$\frac{18}{124}$=3.02g,实际固体质量减少=20.8g-15.9g=4.9g>3.02g,故还发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,最终得到固体15.9g为碳酸钠的质量,根据方程式可知生成水的物质的量等于碳酸钠的物质的量,根据质量减少可以计算生成二氧化碳的物质的量,再计算氢氧化钠与碳酸氢钠反应生成水的物质的量,结合方程式计算样品中氢氧化钠的质量,进而计算其质量分数.
解答 解:加热发生反应:NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O,若NaOH、NaHCO3恰好按1:1反应,固体减少质量为水的质量,根据方程式可知,生成水的质量=20.8g×$\frac{18}{124}$=3.02g,实际固体质量减少=20.8g-15.9g=4.9g>3.02g,故还发生反应:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,最终得到固体15.9g为碳酸钠的质量,其物质的量为$\frac{15.9g}{106g/mol}$=0.15mol,根据方程式可知生成水的物质的量等于碳酸钠的物质的量,即生成水为0.15mol,故生成二氧化碳为$\frac{4.9g-0.15mol×18g/mol}{44g/mol}$=0.05mol,故反应2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O生成水为0.05mol,则反应NaOH+NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O生成水为0.15mol-0.05mol=0.1mol,可知NaOH为0.1mol,则样品中NaOH的质量为0.1mol×40g/mol=4g,原混合物中氢氧化钠的质量分数为$\frac{4g}{20.8g}$×100%=19.2%,
答:原混合物中氢氧化钠的质量分数为19.2%.
点评 本题考查混合物计算、化学方程式计算,利用假设法判断过量问题是解题关键,注意根据方程式判断碳酸钠与水的物质的量关系,较好地考查学生分析计算能力,难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
 在NaOH溶液中很难水解.
在NaOH溶液中很难水解. .
.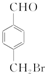 、
、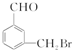 、
、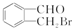 .
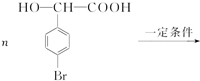
.
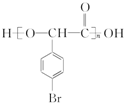 +(n-1)H2O.
+(n-1)H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A的质量 | B. | 混合气体的质量 | ||
| C. | B的物质的量 | D. | 气体的总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
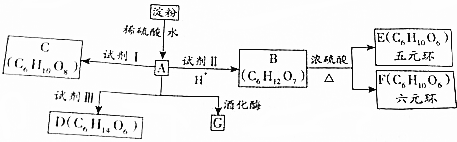
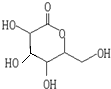 、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.
、OHC(CHOH)4COOH;E、F两种物质的关系是同分异构体.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
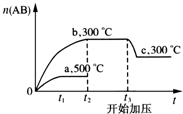 可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )
可逆反应:A2(?)+B2(?)?2AB(?),当温度和压强改变时n(AB)的变化如图,下列叙述正确的是( )| A. | A2、B2及AB均为气体,△H<0 | |
| B. | AB为气体,A2、B2至少有一种为非气体,△H<0 | |
| C. | AB为气体,A2、B2有一种为非气体,△H>0 | |
| D. | AB为固体,A2、B2有一种为非气体,△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮气的化学性质比氧气稳定 | |
| B. | 常温、常压下,溴呈液态,碘呈固态 | |
| C. | 稀有气体一般很难发生化学反应 | |
| D. | 相同状态下,氯气的密度比空气的大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com